1、选择题 X元素的阳离子与Y元素的阴离子具有相同的电子层结构,下列叙述正确的是
A.原子序数X<Y
B.原子半径X<Y
C.离子半径X>Y
D.原子最外层电子数X<Y
参考答案:D
本题解析:X元素的阳离子与Y元素的阴离子具有相同的电子层结构,则X是金属,Y是非金属,位于X的上一周期,所以原子序数X大于Y,原子半径是X大于Y,离子半径是X小于Y。金属元素的最外层电子数一般小于4个,非金属元素的最外层电子数一般大于3个,所以正确的答案是D。
本题难度:一般
2、选择题 X、Y、Z为三种短周期元素,X、Y处在相邻的两个周期,X原子的最外层电子数是Y原子最外层电子数的2倍,Y的原子序数比X的原子序数多5,Z原子与Y原子的最外层电子数之差为3。下列叙述正确的是(?)?
A.X、Y、Z三种元素不能组成一种盐
B.X单质与Z单质直接反应可生成两种化合物
C.X、Y、Z的最高价氧化物对应的水化物,可能是酸、碱或两性的物质
D.X、Y形成的一种离子跟H+反应可生成Y的离子
参考答案:D
本题解析:在短周期元素中,X、Y处在相邻的两个周期,X原子的最外层电子数是Y原子最外层电子数的2倍,Y的原子序数比X的原子序数多5。则X为O,Y为Al.。Z原子与Y原子的最外层电子数之差为3,则Z为S。A.O、S、Al可形成盐Al2(SO4)3。错误。B.O2与S直接反应只能生成SO2。错误。C.O元素无最高价氧化物对应的水化物。错误。AlO2-+4H+=Al3++2H2O。正确。
本题难度:一般
3、填空题 Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为1,3,6,6,且都含有18个电子,B、C由两种元素的原子组成,且分子中两种原子的个数比均为1:2,D是一种有毒的有机物。
(1)组成A分子的原子的元素符号是________。
(2)从B分子的立体结构判断,该分子属于________分子(填“极性”或“非极性”)。
(3)1个C分子中包含________个σ键。
(4)D的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明D是何物质):________。
Ⅱ.CO的结构可表示为CO,N2的结构可表示为NN。
(5)下表是两者的键能数据(单位:kJ·mol-1):
?
| A—B
| A=B
| A≡B
|
CO
| 357.7
| 798.9
| 1071.9
|
N2
| 154.9
| 418.4
| 941.7
|
?
结合数据说明CO比N2活泼的原因:________。
Ⅲ.Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
(6)基态Ni原子的核外电子排布式为________,基态Cu原子的价电子排布式为________。
(7)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于________(填晶体类型)。
参考答案:(1)Ar (2)极性 (3)5 (4)D是CH3OH,分子之间能形成氢键 (5)CO中第一个π键的键能是273 kJ·mol-1,N2中第一个π键的键能是523.3 kJ·mol-1,所以CO的第一个键比N2的第一个键更容易断裂 (6)1s22s22p63s23p63d84s2或[Ar]3d84s2;3d104s1 (7)分子晶体
本题解析:Ⅰ.含有18个电子的微粒有:Ar(18)、HCl(1+17)、H2S(2+16)、PH3(15+3)、SiH4(14+4)、F2(9×2)、H2O2(9×2)、N2H4(9×2)、C2H6(9×2)、CH3F(9+9)、CH3OH(9+9)等。由“A分子所含原子的数目为1,且含有18个电子”可推知A为Ar;由“B分子所含原子的数目为3,且含有18个电子,B由两种元素的原子组成,且分子中两种原子的个数比为1:2”可推知B为H2S,H2S是极性分子;由“C分子所含原子的数目为6,且含有18个电子,C由两种元素的原子组成,且分子中两种原子的个数比为1:2”可推知C为N2H4,1个N2H4分子中含有4个N—H键(4个σ键)和一个N—N键(1个σ键),共5个σ键。由“D分子所含原子的数目为6,且含有18个电子,D是一种有毒的有机物”可推知D为CH3OH,CH3OH分子之间能形成氢键,所以CH3OH的熔、沸点比CH4的熔、沸点高。
Ⅱ.CO打开第一个键需要的能量为1071.9 kJ·mol-1-798.9 kJ·mol-1=273 kJ·mol-1,而N2打开第一个键需要的能量为941.7 kJ·mol-1-418.4 kJ·mol-1=523.3 kJ·mol-1。
Ⅲ.基态Ni原子的核外电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2,基态Cu原子的价电子排布式为3d104s1。Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于分子晶体。
本题难度:一般
4、推断题 A、B、C、D、E、F、G七种短周期主族元素的原子序数依次增大。A和E最外层电子数相同,短周期主族元素的原子中,E原子的半径最大;B、C和F在周期表中相邻,B、C同周期,C、F同主族,F原子的质子数是C原子质子数的2倍;A和C可形成两种常见的液态化合物X和Y(相对分子质量X<Y );D形成的分子为双原子分子。回答问题:
(1)D元素的名称为?, F形成的离子的结构示意图为?。
(2)写出液态化合物Y的一种用途?。
(3)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应,产生的气体可充填气球,请写出该反应的离子方程式? ________?,使用这种气球存在的隐患是?。
(4)P和Q两种物质都是由A、C、E、F四种元素组成的盐,其水溶液都显酸性,等物质的量的P和Q恰好完全反应。写出该反应的离子方程式:?。
(5)A、B、G三种元素两两组合形成的化合物在空气中相遇形成白烟,反应的化学方程式为?。
参考答案:(1)氟?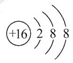
(2)一定浓度的H2O2溶液作消毒剂
(3)2Al+2OH-+2H2O=2AlO2-+3H2↑?易燃、易爆
(4)H++HSO3-=SO2↑+H2O
(5)NH3+HCl=NH4Cl
本题解析:E原子半径在短周期主族元素中最大,E为Na;A与E最外层电子数相同,A、E同主族,A为H;C元素在第二周期,H元素与C元素形成两种常见的液态化合物,C为氧元素;F质子数是C的2倍,F为S;B、C同周期且相邻,B为N;D为F;G为Cl。
(1)D元素名称为氟,S2-的结构示意图为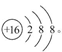
(2)化合物Y为H2O2,可以作医用消毒剂和漂白剂等。
(3)Al与NaOH溶液反应产生H2,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。氢气球存在的问题是易燃、易爆。
(4)H、O、Na、S形成的化合物都显酸性,则为NaHSO4和NaHSO3,反应的离子方程式为:H++HSO3-=SO2↑+H2O。
(5)H、N、Cl三种元素形成的NH3与HCl反应的化学方程式为:NH3+HCl=NH4Cl。
本题难度:一般
5、选择题 用半透膜把分子或离子从胶体中分离出来的方法叫
A.电泳
B.电解
C.聚沉
D.渗析
参考答案:D
本题解析:可用渗析方法精制胶体,因为分子或离子可以透过半透膜.
本题难度:困难