1、选择题 下列说法中错误的是
A.金属钠与氯气反应生成氯化钠后,其结构的稳定性增强,体系的能量降低
B.物质的燃烧可 以看作为“储存”在物质内部的能量(化学能)转化为热能释放出来
以看作为“储存”在物质内部的能量(化学能)转化为热能释放出来
C.氮气分子内部存在着很强的共价键,故通常情况下氮气的化学性质很活泼
D.需要加热才能发生的反应不一定是吸收能量的反应
参考答案:C
本题解析:略
本题难度:一般
2、选择题 反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是(双选)?( )。
C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是(双选)?( )。
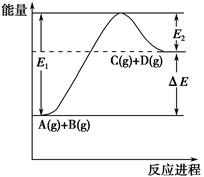
A.该反应是放热反应
B.加入催化剂后,反应加快,ΔE减小
C.反应物的总键能大于生成物的总键能
D.反应达到平衡时,升高温度,A的转化率增大
参考答案:CD
本题解析:由图像可知反应物总能量低于生成物总能量,故该反应为吸热反应;加入催化剂反应速率增大,降低了活化能,但不能改变反应热大小,故A、B错误。
本题难度:简单
3、选择题 下列有关能量转化的认识不正确的是
[? ]
A.植物的光合作用使太阳能转化为化学能?
B.人类使用照明设备是将电能转化为光能 ?
C.生物体内的化学变化过程在能量转化上常比在体外发生的一些能量转化更为合理,有效?
D.燃料燃烧时只是将化学能转化为热能
参考答案:D
本题解析:
本题难度:简单
4、选择题 在一定条件下,将64 g二氧化硫气体氧化成三氧化硫气体时,实验测得放出热量为78.64 kJ,已知二氧化硫在此条件下的转化率为80%。下列热化学方程式书写正确的是( )
A.SO2(g)+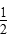 O2(g)
O2(g)  SO3(g)ΔH=-98.3 kJ·mol-1
SO3(g)ΔH=-98.3 kJ·mol-1
B.2SO2(g)+O2(g)  2SO3(l)ΔH=-196.6 kJ·mol-1
2SO3(l)ΔH=-196.6 kJ·mol-1
C.SO2(g)+ O2(g)
O2(g)  SO3(g)ΔH=-78.64 kJ·mol-1
SO3(g)ΔH=-78.64 kJ·mol-1
D.2SO2(g)+O2(g)  2SO3(g)ΔH=+196.6 kJ·mol-1
2SO3(g)ΔH=+196.6 kJ·mol-1
参考答案:A
本题解析:根据题目可知该反应为放热反应,ΔH<0,D选项错误;“l”表示液态,题目要求的是生成三氧化硫气体,B选项错误;可逆反应中的ΔH指的是其完全反应时放出的热量,与其是否可逆和转化率无关,C选项错误。n(SO2)=1 mol,参加反应0.8 mol,放出热量为78.6 kJ,若参加反应的SO2是1 mol,则放出的热量为98.3 kJ,故A正确。
本题难度:一般
5、填空题 能源危机促使世界各国寻找新的替代能源和开展对已有能源“高效利用”的技术研发。设计燃料电池使汽油氧化直接产生电流是本世纪最富有挑战性的课题之一。以丁烷(已知丁烷的燃烧热为2 877.6 kJ·mol-1)为代表回答下列问题:
(1)写出丁烷燃烧的热化学方程式:________________;
(2)正丁烷的燃烧热:2 878 kJ·mol-1,异丁烷的燃烧热:2 869 kJ·mol-,正丁烷转化为异丁烷的过程中________(填“放出”或“吸收”)能量。
参考答案:(1)2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l) ΔH=-5 755.2 kJ·mol-1
(2)放出
本题解析:(1)2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l) ΔH=-5 755.2 kJ·mol-1 ①
2C4H10(正丁烷,g)+13O2(g)=8CO2(g)+10H2O(l) ΔH=-5 756 kJ·mol-1 ②
2C4H10(异丁烷,g)+13O2(g)=8CO2(g)+10H2O(l) ΔH=-5 738 kJ·mol-1 ③
利用盖斯定律将②-③再除以2得C4H10(正丁烷,g)=C4H10(异丁烷,g) ΔH=-9 kJ·mol-1,该反应为放热反应。
本题难度:简单