1、选择题 H2在O2中燃烧生成气态H2O的反应是一个放热反应,在反应过程中
A.核能转化成热能
B.生成物的总能量等于反应物的总能量
C.化学能转化成热能
D.生成物的总能量大于反应物的总能量
参考答案:C
本题解析:反应放热,说明反应物的总能量高于生成物的总能量,答案选C。
点评:该题是高考中的常见考点,属于基础性知识的考查。主要是考查学生对反应热概念和影响反应热大小因素的熟悉掌握程度,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:简单
2、选择题 将20g Ba(OH)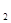 ·8H
·8H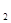 O晶体与10 g NH
O晶体与10 g NH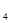 Cl晶体一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。则下列说法正确的是
Cl晶体一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。则下列说法正确的是
A.实验中玻璃棒的作用是加速固体溶解
B.玻璃片上结冰而与小烧杯粘在一起,说明该反应是放热反应
C.所取反应物质量的多少会影响反应是吸热,还是放热
D.该反应中,反应物的总能量小于生成物的总能量
参考答案:D
本题解析:根据题意:将20g?Ba(OH)2?8H2O晶体与10g?NH4Cl晶体一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌,可以知道玻璃棒的作用是:搅拌使混合物充分接触并反应,A不正确;玻璃片上结冰而与小烧杯粘在一起,说明该反应是吸热反应,B不正确;反应是放热反应还是吸热反应,只与反应物总能量和生成物总能量的相对大小有关系,C不正确;该反应是吸热反应,因此反应物的总能量低于生成物的总能量,D正确,答案选D。
点评:该题是基础性试题的考查,试题紧扣教材,基础性强,侧重对学生基础知识的检验和训练,难度不大。注意玻璃棒在化学实验中作用。
本题难度:一般
3、选择题 参照反应Br+H2 ?HBr+H的能量对反应历程的示意图,下列叙述中正确的是(? )
?HBr+H的能量对反应历程的示意图,下列叙述中正确的是(? )

A.正反应为放热反应
B.加入催化剂,该化学反应的反应热变大
C.反应物总键能高于生成物总键能
D.升高温度可增大正反应速率,降低逆反应速率
参考答案:C
本题解析:由图示可知,产物总能量高于反应物总能量,则正反应为吸热反应;催化剂会降低活化能,但反应热决定于反应物与产物的能量差,是定值;升温时正逆反应速率均会增大;C项:反应热=反应物总键能-生成物总键能>0,符合题意。
本题难度:一般
4、选择题 科学家发现,不管化学反应是一步完成还是分几步完成,该反应的热效应是相同的,已知在25℃、105Pa时,1molC(石墨)完全燃烧生成CO2气体,放热393.5kJ,1molCO完全燃烧生成CO2气体,放热283.0kJ,下列说法正确的是( )
A.在25℃、105Pa时,C(石墨)燃烧生成CO气体的热化学方程式是2C(石墨s)+O2(g)═2CO(g)△H=-110.5kJ/mol
B.C(石墨)不完全燃烧,生成CO2和CO混合气体时,放热283.0kJ
C.C(石墨)和CO2(g)反应生成CO(g)的反应是吸热反应
D.如果金刚石燃烧生成CO2的反应放出的热量大于石墨燃烧生成CO2放出的热量,则可断定从石墨变为金刚石的变化需要吸热
参考答案:A、石墨、一氧化碳的燃烧热分别是393.5kJ?mol-1和283.0KJ?mol-1,
石墨燃烧的热化学方程式为(1)C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ/mol;
一氧化碳燃烧的热化学方程式为(2)CO(g)+1/2O2(g)═CO2(g)△H2=-283.0kJ/mol;
根据盖斯定律,(1)-(2)得C(石墨)+1/2O2(g)=CO(g)△H=-110.5kJ?mol-1,
即2C(石墨)+O2(g)=2CO(g)△H=-221kJ?mol-1,故A错误;
B、1mol石墨不完全燃烧生成CO2和CO,无法计算生成CO2和CO各自物质的量,无法计算具体反应热,故B错误;
C、石墨燃烧的热化学方程式为(1)C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ/mol;
一氧化碳燃烧的热化学方程式为(2)CO(g)+1/2O2(g)═CO2(g)△H2=-283.0kJ/mol;
根据盖斯定律,(1)-(2)×2得C(s,石墨)+CO2(g)=2CO(g)△H=+172.5kJ?mol-1,反应是吸热反应,故C正确;
D、金刚石的燃烧热大于石墨的燃烧热,根据能量守恒,可知金刚石的能量比石墨能量高,所以石墨转变为金刚石需要吸热,故D正确;
故选CD.
本题解析:
本题难度:一般
5、选择题 下列说法中,不正确的是?(?)?
A.焓变为正值的反应都是吸热反应
B.放热的熵增加反应一定能自发进行
C.同一条件下,氨水在物质的量浓度不同的溶液中,其电离程度是不相同的
D.强电解质都是离子化合物,弱电解质都是共价化合物
参考答案:D
本题解析:略
本题难度:简单