1、选择题 常温下,取物质的量浓度相等的NaOH和HCl溶液,以3:2体积比相混合,所得溶液pH=12,设混合溶液体积变化忽略不计,则原溶液的浓度为( )
A.0.01mol/L
B.0.05mol/L
C.0.017mol/L
D.0.50mol/L
参考答案:物质的量浓度相等的NaOH和HCl溶液,以3:2体积比相混合,发生反应:NaOH+HCl=NaCl+H2O ,氢氧化钠有剩余,令二者的浓度为cmol/L,则反应后溶液中c(OH-)=3c-2c3+2mol/L=c5mol/L,根据混合后溶液的pH=12,可知应后溶液中c(OH-)=0.01mol/L,即c5mol/L=0.01mol/L,解得c=0.05,
故选B.
本题解析:
本题难度:一般
2、简答题 将10.6g?Na2CO3溶于水配成250mL溶液,请计算:
(1)溶液中溶质的物质的量
(2)溶液中Na+和CO32-的物质的量浓度.
参考答案:(1)溶质的物质的量为10.6g?106g/mol?=0.1mol,故溶液中溶质的物质的量为0.1mol;
(2)Na2CO3的物质的量浓度为0.1?mol0.25L=0.4mol/L,c(Na+)=2c(Na2CO3)=0.8mol/L,c(CO32-)=c(Na2CO3)=0.4mol/L,故溶液中Na+和CO32-的物质的量浓度分别为0.8mol/L、0.4mol/L.
本题解析:
本题难度:一般
3、选择题 有硫酸镁溶液500mL,它的密度是1.20g-cm-3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是( )
A.溶质的质量分数是24.0%
B.溶液的物质的量浓度是2.4mol/L
C.溶质和溶剂的物质的量之比是1:40
D.硫酸根离子的质量分数是19.2%
参考答案:A、该硫酸镁溶液的质量为1.220g?cm-3×500mL=600g,硫酸镁的分子量为120,镁的原子量为24,硫酸根离子的分子量为96,所以镁离子在硫酸镁分子中的含量为24120×100%=20%,其中镁离子的质量为600g×4.8%=28.8g,所以溶液中硫酸镁的质量为28.80.2=144g,该硫酸镁溶液的质量分数为144g600g×100%=24%,故A正确;
B、溶液中硫酸镁的质量为144g,其物质的量为:144g120g/mol=1.2mol,根据c=nV,溶液的物质的量浓度为1.2mol0.5L=2.4mol/L,故B正确;
C、溶液中的溶剂水的质量为:600g×(1-24%)=456g,水的分子量为18,所以该硫酸镁溶液中水的物质的量为456g18g/mol=25.33mol,溶液中硫酸镁的质量为144g,其物质的量为1.2mol,所以溶质与溶剂物质的量之比为1.2:25.33=1:21.11,故C错误;
D、1分子硫酸镁在水中可电出1分子硫酸根离子,所以硫酸根离子的物质的量等于硫酸镁物质的量,即1.2mol,其质量为1.2mol×96g/mol=115.2g,所以溶液中硫酸根离子的质量分数为:115.2g600g×100%=19.2%,故D正确.
故选C.
本题解析:
本题难度:一般
4、实验题 如图是某同学配制一定质量的0.9%生理盐水的全过程
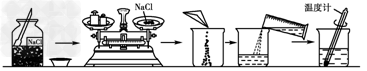
(1)请你指出图中的错误:
①_______________________;②__________________;③______________。 ?
(2)如果配制的生理盐水中NaCl的质量分数小于0.9%,则可能造成误差的原因有(至少举出三点):
①______________________________;
②______________________________;
③______________________________。
参考答案:(1)①试剂瓶塞放反了(或瓶塞放反了);②砝码和药品放反了;③用温度计来搅拌
(2)①水计算多了;②氯化钠计算少了;③天平读数有误;④氯化钠和砝码放反了;⑤左盘放了纸片右盘未放纸片;⑥天平未调零等。⑦水量多了(或取水读数时仰视);⑧氯化钠中混有杂质;⑨烧杯中原来有水(任选三点即可)
本题解析:
本题难度:一般
5、选择题 质量分数为a的某物质的溶液mg与质量分数为b的该物质的溶液ng混合后,蒸发掉pg水.得到的溶液每毫升质量为qg,物质的量浓度为c.则溶质的相对分子质量为
[? ]
A.
B.
C.
D.
参考答案:C
本题解析:
本题难度:一般