1、选择题 20℃时,饱和KCl溶液的密度为1.174 g·cm-3,物质的量浓度为4.0mol·L-1,则下列说法不正确的是
[? ]
A.30℃时,饱和KCl溶液的浓度大于4.0mol·L-1
B.30℃时,饱和KCl溶液的密度大于1.174 g·cm-3
C.将此溶液蒸发部分水,再恢复到20℃时,溶液的浓度大于4.0mol·L-1
D.将此溶液蒸发部分水,再恢复到20℃时,溶液的密度仍为1.174 g·cm-3
参考答案:C
本题解析:
本题难度:一般
2、简答题 计算题:常温下,将20.0g 14%的NaCl溶液与30.0g 24%的NaCl溶液混合,混合后得到密度为1.17g/cm3的溶液.请计算(无解题过程不得分):
①混合后溶液中NaCl的质量分数;
②混合后溶液中NaCl的物质的量浓度;
③在1000g水中加多少molNaCl,才能使其浓度恰好与上述混合后溶液的浓度相等(结果保留一位小数).
参考答案:①将20.0g14%的NaCl溶液跟30.0g24%的NaCl溶液混合,混合后溶液的质量为20g+30g=50g,
令混合后NaCl的质量分数为ω,则:50g×ω=20g×14%+30g×24%,
解得ω=20%
答:混合后NaCl溶液的质量分数为20%.
②混合后溶液中NaCl的物质的量浓度为1000×1.17×20%58.5mol/L=4mol/L,
答:混合后氯化钠溶液的物质的量浓度为4mol/L.
③令需要氯化钠的物质的量为n mol,NaCl的质量为n mol×58.5g/mol=58.5g,则:
58.5n1000+58.5n=20%,
解得n=4.3,
答:在1000g水中需要加入4.3molNaCl.
本题解析:
本题难度:一般
3、选择题 下列说法正确的是(?)
A.含n molHCl的浓盐酸与足量MnO2反应可生成n NA /4 个氯分子()
B.在密闭容器中建立了N2+3H2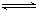 2NH3的平衡,每有17gNH3生成,必有0.5NA个NH3分子分解
2NH3的平衡,每有17gNH3生成,必有0.5NA个NH3分子分解
C.同温同压同体积的CO2和SO2所含氧原子数均为2NA
D.20 g重水(D2O)中含有的电子数为10NA
参考答案:D
本题解析:浓盐酸在和二氧化锰的反应中,浓度会逐渐变稀,而稀盐酸不能和二氧化锰反应,所以选项A中生成的氯气小于n NA /4 个;选项B不正确,因为反应达到平衡状态时正逆反应速率是相等的;选项C不正确,二者不一定都是1mol;20g重水是1mol,含有10mol电子,所以答案选D。
本题难度:一般
4、选择题 NA为阿伏伽德罗常数的值,下列叙述不正确的是
A.常温常压下,8gO2含有4 NA个电子
B.0.5mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA
C.14g分子式为CnH2n的链烃中含有的碳碳双键的数目为
D.25℃时,pH=13的1.0 L Ba(OH)2溶液中含有OH-的数目为0.2NA