1、简答题 已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
(1)若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
a.甲+H2O
乙+丙?b.乙氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则该金属在周期表中的位置是:______.
②若甲为某短周期金属元素的氯化物,则甲发生a反应的化学方程式为:______.
③将以上两种金属单质用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,则负极发生的电极反应为______.
(2)若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙丙.则:
①甲的结构式为______.
②写出上述反应的化学方程式______.
③写出在200mL?2mol/L的NaOH溶液中通入6.72L(标准状况)的气体甲发生完全反应的总离子方程式______.
参考答案:(1)①甲为三价金属氯化物,常见的只有铝和铁,又因为生成的氯化物为红棕色粉末,所以甲一定为FeCl3,铁位于周期表中第四周期第Ⅷ族,
故答案为:第四周期,第Ⅷ族;
②如果甲为短周期金属元素的氯化物,则只可能为氯化铝;其水解反应式为:AlCl3+3H2O?加热?.?Al(OH)3↓+3HCl↑,故答案为:AlCl3+3H2O?加热?.?Al(OH)3↓+3HCl↑;
③由于在碱性溶液中,只有铝能失电子发生反应而铁不能,所以负极反应式为:Al-3e-+4OH-=AlO2-+2H2O,故答案为:Al-3e-+4OH-=AlO2-+2H2O;
(2)甲、乙、丙为短周期元素,乙为固体单质,甲丙为气体,甲、乙高温下生成丙,且三者均位于同一周期,只可能为C、N、O三元素组成的化合物,综合分析可知:甲为CO2,乙为碳,丙为CO.
①甲为CO2,为直线形分子,结构式为,故答案为:O=C=O;
②反应的方程式为CO2+C?高温?.? 2CO,故答案为:CO2+C?高温?.? 2CO;
③在0.4mol?NaOH溶液中通入0.3mol?CO2,得到的产物既有碳酸钠又有碳酸氢钠,反应的离子方程式为3CO2+4OH-=2HCO3-+CO32-+H2O,
故答案为:3CO2+4OH-=2HCO3-+CO32-+H2O.
本题解析:
本题难度:一般
2、填空题 由两种常见金属组成的混合物A,在合适的条件下可按下图进行反应(部分产物和水省略),已知F为红褐色沉淀,请回答:

(1)混合物A的成分是 ?(请填化学式)。
(2)写出反应①的离子方程式为:??。
(3)写出反应②的化学方程式为:??。
参考答案:(1)Fe? Al
(2)2Al+2OH-+2H2O= 2AlO2-+3H2↑
 ?(3)4Fe(OH)2+O2+2H2O=4Fe(OH)3
?(3)4Fe(OH)2+O2+2H2O=4Fe(OH)3
本题解析:略
本题难度:简单
3、简答题 如图为一些常见无机物之间的转化关系,已知X是-种盐,H是金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.试回答下列问题:
(1)G的化学式为:______.在反应①中,每生成2.24L(标准状况下)气体F,反应转移电子的物质的量为______.
(2)写出下列反应的化学方程式
①______;②______.
(3)X在医药上用作解酸剂,与盐酸作用时,生成B的物质的量与消耗盐酸的物质的量之比为3:8,则X的化学式为______;X与盐酸反应的化学方程式为______.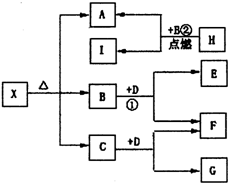
参考答案:H是金属单质,在B中点燃反应生成A、I,I是常见非金属单质,推断为:H为Mg,I为C,A为MgO,B为CO2;B+D=E+F,F为非金属单质,E为工业上重要的碱性物质,推断为:D为Na2O2,E为Na2CO3,F为O2,G是工业上重要的碱性物质,C+Na2O2=G+O2;可以判断:G为NaOH,C为H2O;
(1)G的化学式为:NaOH,反应①发生的反应是2Na2O2+2CO2=2Na2CO3+O2,每生成1molO2,电子转移为2e-,每生成2.24L(标准状况下)气体F(O2)物质的量为0.1mol,反应转移电子的物质的量为0.2mol,故答案为:NaOH;0.2mol;
(2)反应①的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2;②的化学方程式为:2Mg+CO2?点燃?.?2MgO+C,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;2Mg+CO2?点燃?.?2MgO+C;
(3)X在医药上用作解酸剂,X为镁的碳酸盐,与盐酸作用时,生成B(CO2)的物质的量与消耗盐酸的物质的量之比为3:8,生成产物氯化镁二氧化碳和水,依据反应中原子守恒和反应性质可知,1molX中含碳酸根离子为3mol,含镁离子4mol,依据化合价代数和为0和原子守恒得到X的化学式为Mg4(OH)2(CO3)3或Mg(OH)2?3MgCO3;
与盐酸反应的化学方程式:Mg4(OH)2(CO3)3+8HCl=4MgCl2+3CO2↑+5H2O,
故答案为:Mg4(OH)2(CO3)3+8HCl=4MgCl2+3CO2↑+5H2O.
本题解析:
本题难度:一般
4、选择题 右图是一种试验某气体化学性质的实验装置,图中B为开关。
如果先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;
当关闭B时,C中红色布条颜色褪去。则D瓶中盛有的溶液是( )

A.饱和NaCl溶液
B.浓H2SO4
C.浓NaBr溶液
D.浓NaOH溶液
参考答案:A
本题解析:
正确答案:A
A、通过NaCl溶液,气体变湿,能使红布条褪色,B、浓H2SO4作干燥剂;C、浓NaBr溶液与氯气反应生成溴;D、能将氯气吸收。
本题难度:一般
5、填空题 已知A、B,C为中学化学中常见的单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们可以按下图进行反应。
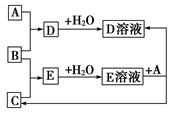
回答下列问题:
(1)A、B、C三种元素中的任意两种元素形成的化合物所属物质类别一定不是________。
①氢化物 ②酸 ③碱 ④盐 ⑤氧化物
(2)A、B、C三种元素中有一种是金属,则这种元素是A、B、C中的________,理由是________。
(3)如果E溶液是一种强酸,则E的化学式为________。
参考答案:(1)③⑤
(2)A 金属单质在室温下不可能为气态物质 (3)HCl
本题解析:符合框图关系的可为A为Mg、Al、Zn(不能为Fe),B为Cl2,C为H2。
本题难度:一般