| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《盐类水解的原理》考点巩固(2020年最新版)(八)
参考答案:B 本题解析:向NaX溶液中通CO2气体,只能生成HX和NaHCO3;则酸性H2CO3>HX> HCO 本题难度:困难 2、填空题 (7分)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂, 参考答案: 本题解析: 本题难度:困难 3、选择题 往FeCl3溶液中加入下列溶液后,不会出现红褐色沉淀的是 |
参考答案:B
本题解析:A、氯化铁可以氨水反应生成红褐色沉淀,A错误;B、氯化铁和硫酸铜之间不发生反应,正确;
C、氯化铁可以和氢氧化钠之间会发生反应生成氢氧化铁红褐色沉淀,错误;D、氯化铁和NaHCO3溶液之间水解相互促进,生成红褐色沉淀和CO2气体,错误;选B。
考点:考查铁盐的化学性质。
本题难度:一般
4、选择题 下列所述事实与化学(离子)方程式不相符的是
A.能说明非金属性Cl > C: 2HCl+CaCO3==CaCl2+CO2↑+H2O
B.能说明氧化性H2O2 > Fe3+: 2Fe2++H2O2+2H+ ==2Fe3++2H2O
C.已知:H+(aq)+OH—(aq)="=H2O(l)" ΔH=-57.3kJ·mol-1(稀溶液),能说明稀硫酸与NaOH稀溶液反应生成1mol水,放出的热量为57.3 kJ
D.能说明CH3COOH是弱电解质: CH3COO—+H2O 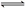 CH3COOH+OH—
CH3COOH+OH—
参考答案:A
本题解析:A、非金属性的比较可通过最高价含氧酸的酸性的强弱来比较,盐酸的酸性大于碳酸,但盐酸是Cl元素的非含氧酸,不能用来与碳酸的酸性作比较,来判断非金属性的强弱,错误;B、根据氧化剂的氧化性大于氧化产物的氧化性,在该反应中氧化剂是过氧化氢,氧化产物是铁离子,所以能说明氧化性H2O2 > Fe3+,正确;C、稀硫酸与氢氧化钠反应生成硫酸钠和水,可用H+(aq)+OH—(aq)==H2O(l)表示,所以稀硫酸与NaOH稀溶液反应生成1mol水,放出的热量为57.3 kJ,正确;D、醋酸根离子在水中发生水解反应,生成醋酸,可以说明醋酸是弱酸,正确,答案选A。
考点:考查对离子方程式的理解,非金属性、氧化性的比较
本题难度:一般
5、选择题 常温时向水中加入少量固体MgCl2,水的电离被______;与纯水相比,所得溶液中KW 。
A.促进? 不变
B.促进? 减小
C.抑制? 不变
D.抑制? 变小
参考答案:A
本题解析:氯化镁是强酸弱碱盐,Mg2+水解显酸性,促进水的电离。由于温度不变,水的离子积常数不变,所以答案选A。
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《物质的量》.. | |