1、选择题 下列说法正确的是( )
A.第一电离能大的原子一定不能发生化学反应
B.X、Y位于同周期,X电负性大于Y电负性则X的第一电离能一定大于Y的第一电离能
C.在所有元素中,氦的第一电离能最大
D.元素的电负性越大则元素的非金属性越弱
参考答案:C
本题解析:
本题难度:一般
2、填空题 已知元素原子的电负性和原子半径等一样,也是元素的一种基本件质,下列给出14种元素的电负性

试结合元素周期律知识完成下列问题:
(1)根据上表给出的数据,可推知元素的电负性具有的变化规律是_____________。
(2)由上述变化规律可推断,短周期主族元素中,电负性最大的元素是____________,电负性最小的元素是__________,由这两种元素构成的化合物属于___________(用“离子”或“共价”填空)化合物,并用电子式表示该化合物的形成过程:__________________
参考答案:(1)元素的电负性随着原子序数的递增呈周期性的变化(或同周期主族元素,从左到右,电负性逐渐增大)
(2)F;Na;离子;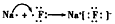
本题解析:
本题难度:一般
3、填空题 根据下列五种元素的电离能数据(单位:kJ/mol),回答(1)~(5)小题:
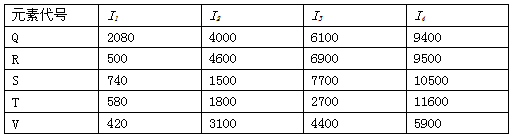
(1)在周期表中,最可能处于同一族的是:____________
A.Q和R B.S和T C.T和V D.R和V
(2)若R、S、T、V均为金属元素,且R、S、T同周期,则这四种元素中最活泼的是:____________
A.R B.S C.T D.V
(3)S元素最可能是:____________
A.s区元素 B.p区元素 C.d区元素 D.稀有气体元素
(4)由T元素形成的氯化物的化学式为:___________
A.TCl B.TCl2 C.TCl3 D.TCl4
(5)下列元素中物理性质和化学性质最像Q元素的是:_____________
A.氢 B.氦 C.碳 D.铍
参考答案:(1)D
(2)G
(3)F
(4)B
(5)E
本题解析:
本题难度:一般
4、简答题 2010年上海世博会场馆大量的照明材料或屏幕都使用了发光二极管(LED).目前市售LED晶片材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主.已知镓是铝同族下一周期的元素.砷化镓的晶胞结构如图.试回答:
(1)镓的基态原子的电子排布式是______.
(2)比较二者的第一电离能:As______Ga(填“<”、“>”或“=”).
(3)砷化镓晶胞中所包含的砷原子(白色球)个数为______,与同一个镓原子相连的砷原子构成的空间构型为______.
(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得.(CH3)3Ga中镓原子的杂化方式为______.
(5)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是______.(用氢化物分子式表示)
(6)下列说法正确的是______(填字母).
A.砷化镓晶胞结构与NaCl相同?B.GaP与GaAs互为等电子体
C.电负性:As>Ga?D.砷化镓晶体中含有配位键.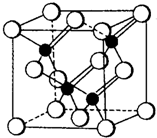
参考答案:(1)镓位于周期表中第四周期第IIIA,故其核外电子排布式为1s22s22p63d104s24p1或[Ar]3d104s24p1,
故答案为:1s22s22p63d104s24p1;
(2)As和Ga处于同一周期,而处于VA的As外围电子处于半满的较稳定结构,故As的第一电离能大于Ga,
故答案为:>;
(3)根据“均摊法”:白色球个数为6×12+8×18)=4.由晶胞图可知与同一个镓原子相连的砷原子构成的空间构型为正四面体,故答案为:4;正四面体;
(4)由于Ga原子周围只有3对成键电子对,故其杂化方法为sp2,故答案为:sp2;
(5)由于NH3分子间存在氢键,所以NH3的沸点最高,由于AsH3的相对分子质量大于PH3,故AsH3的沸点高于PH3,
故答案为:NH3>AsH3>PH3;
(6)A.NaCl晶体中阴阳离子的配位数为6,而砷化镓晶胞中中阴阳离子的配位数为8,二者晶体结构不同,故A错误;
B.根据等电子体的概念可知二者价电子数相等,属于等电子体,故B正确;
C.周期表同周期元素从左到右元素的电负性逐渐增大,则As>Ga,故C正确;
D.由于Ga原子最外层只有3个电子,而每个Ga原子与4个As原子成键,因此其中一个共价键必为配位键,故D正确.
故答案为:BCD.
本题解析:
本题难度:一般
5、选择题 下列分子中,键的极性最强的是
[? ]
A.PH3?
B.H2S
C.HBr
D.HCl
参考答案:D
本题解析:
本题难度:简单