1、填空题 (1)下列实验能达到预期目的是______(填序号,下同)
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
②将Cl2的制备和性质实验联合进行以减少实验中的空气污染
③用食醋和澄清石灰水验证蛋壳中含有碳酸盐
④将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
⑤用溴水检验汽油中是否含有不饱和脂肪烃
(2)实验室需要配制0.5mol?L-1的烧碱溶液500mL,根据溶液配制的过程,回答下列问题:
①实验中除了托盘天平(带砝码)、药匙、量筒和玻璃棒外,还需要的其它玻璃仪器有:______;
②所需NaOH固体的质量为______g;
③配制溶液的过程中,下列操作会导致实际浓度偏高的是______.
A.使用的砝码部分生锈
B.定容时俯视容量瓶的刻度线
C.选用的容量瓶内残留有少量蒸馏水
D.定容、摇匀后,发现液面低于刻度线,再加水至刻度线
④玻璃棒在该实验中的作用有:______和______.
参考答案:(1)①乙酸乙酯在浓硫酸作用下会发生水解反应,可以用饱和碳酸钠来除去乙酸乙酯中的少量乙酸,故①错误;
②氯气有毒会导致空气污染,将Cl2的制备和性质实验联合进行,消耗产生的氯气,可以减少实验中的空气污染,故②正确;
③鸡蛋壳的主要成分碳酸钙可以和食醋发生反应生成二氧化碳,二氧化碳可以使石灰水变浑浊,故③正确;
④水和乙醇是互溶的,所以不能用乙醇做萃取剂,故④错误;
⑤不饱和脂肪烃中的不饱和键可以使溴水褪色,故⑤正确.
故答案为:②③⑤;
(2)①配制一定物质的量浓度的溶液所选取实验仪器有托盘天平(带砝码)、药匙、量筒和玻璃棒、500mL容量瓶、烧杯、胶头滴管,故答案为:500mL容量瓶、烧杯、胶头滴管;
②所需NaOH固体的质量m=nM=cVM=0.5mol/L×0.5L×40g/mol=10g,故答案为:10g;
③根据公式c=nV,A.使用的砝码部分生锈,则实际n偏高,故导致实际浓度偏高,故A正确;
B.定容时俯视容量瓶的刻度线,则V偏小,故导致实际浓度偏高,故B正确;
C.选用的容量瓶内残留有少量蒸馏水,不影响实验结果,故C错误;
D.定容、摇匀后,发现液面低于刻度线,再加水至刻度线,相当于将溶液稀释,结果偏小,故D错误.
故选AB.
④在氢氧化钠固体的溶解时,玻璃棒的作用是搅拌,在移液操作中,玻璃棒的作用是引流,故答案为:搅拌,加速氢氧化钠固体的溶解;引流,防止液体外溅.
本题解析:
本题难度:一般
2、简答题 实验室要配制0.5mol/L的NaOH溶液100mL,则:
(1)需要固体NaOH的质量为______;
(2)用托盘天平称量NaOH固体时,必须把NaOH放在______仪器中称量;
(3)配制时还需要用到的仪器有______(填字母)
A.烧杯 ?B.铁架台(带铁夹)?C.100mL容量瓶?D.50mL容量瓶? E.蒸馏烧瓶?F.胶头滴管?G.玻璃棒
(4)按实验先后顺序排列下列实验步骤______(填编号)
①将称量好的NaOH固体倒入烧杯中;
②往烧杯中倒入约20mL蒸馏水;
③将溶解并冷却后的NaOH溶液移入容量瓶;
④向容量瓶中加蒸馏水到液面离瓶颈刻度线下1~2cm;
⑤用适量蒸馏水洗涤烧杯和玻璃棒2~3次;
⑥将洗涤后的溶液也注入容量瓶中;
⑦盖好瓶塞,反复上下颠倒、摇匀;
⑧用胶头滴管滴加蒸馏水至液面与瓶颈刻度线相切.
(5)以下因素会造成所配制的NaOH溶液物质的量浓度果偏低的是______
A.NaOH溶液未经冷却后马上转移入容量瓶中
B.定容后发现液面低于刻度线补加蒸馏水
C.有少量NaOH溶液残留在烧杯中
D.容量瓶中原来有少量蒸馏水
(6)为检验精盐纯度,需配制250mL?0.2mol/L?NaCl(精盐)溶液,右图是该同学转移溶液的示意图,其中的错误是______.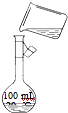
参考答案:(1)配制0.5mol/L的NaOH溶液100mL,需氢氧化钠的质量为m=0.5L×0.1mol?L-1×40g/mol=2.0g,
故答案为:2.0g;
(2)氢氧化钠具有腐蚀性且易潮解,应放在烧杯内迅速称量,故答案为:烧杯;
(3)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有托盘天平、烧杯、玻璃棒、100mL容量瓶、胶头滴管、药匙,
故选:ACFG;
(4)由(3)中操作步骤可知,实验先后顺序①②③⑤⑥④⑧⑦,故答案为:①②③⑤⑥④⑧⑦;
(5)A.液体具有热胀冷缩的性质,氢氧化钠溶解放热,未冷却到室温,趁热将溶液到入容量瓶,并配成溶液,冷却后会导致溶液体积偏小,溶液浓度偏高,故A不符合;
B.定容后发现液面低于刻度线,可以补加蒸馏水至刻度线,对所配溶液浓度无影响,故B不符合;
C.有少量NaOH溶液残留在烧杯中,移入容量瓶内氢氧化钠的物质的量减小,所配溶液浓度偏低,故C符合;
D.配制需加水定容,容量瓶中原来有少量蒸馏水,对所配溶液浓度无影响,故D不符合;
故选C;
(6)该同学向容量瓶内移液需用玻璃棒引流,防止溶液洒落,故答案为:未用玻璃棒引流.
本题解析:
本题难度:一般
3、简答题 把18.0mol?L-1的浓硫酸稀释成2.00mol?L-1的稀硫酸100ml,实验操作如下,请把正确操作步骤(用1,2,3…表示)的序号填入括号内,并填写有关的空格:
(______)将配好的稀硫酸倒入试剂瓶中,贴好标签;
(______)盖好容量瓶塞,反复颠倒摇匀;
(______)用量筒量取______ml的18.0mol?L-1的浓硫酸;
(______)沿烧杯内壁慢慢注入盛有少量______的烧杯中;
(______)用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
(______)将已冷却至室温的硫酸溶液沿玻璃棒注入______;
(______)改用胶头滴管逐滴加蒸馏水,至______;
(______)继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处.
参考答案:操作步骤有量取、稀释、移液、洗涤、定容、摇匀、装瓶贴标签等操作,即先用量筒量取 11.1ml的18.0mol?L-1的浓硫酸→沿烧杯内壁慢慢注入盛有少量蒸馏水的烧杯中→将已冷却至室温的硫酸溶液沿玻璃棒注入容量瓶→用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中→继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处→改用胶头滴管逐滴加蒸馏水,至凹液面要与刻度线相切→盖好容量瓶塞,反复颠倒摇匀→将配好的稀硫 酸倒入试剂瓶中,贴好标签,所以顺序为8、7、1、2、4、3、6、5.
设量取浓硫酸的体积为V,18.0mol?L-1×V=2.00mol?L-1×0.1L,V=0.0111L=11.1mL;
浓硫酸稀释时,要把浓硫酸倒入蒸馏水中,并不断搅拌,防止液体飞溅;
正确选取容量瓶的规格,选取的容量瓶规格与需要配置溶液的体积相等或稍大于需要配置溶液的体积,故选100mL容量瓶;
因为溶液的表面是凹液面,所以定容时,溶液的凹液面要与刻度线相切.
故答案为:8、7、1、2、4、3、6、5;11.1mL;蒸馏水;100mL容量瓶;凹液面要与刻度线相切.
本题解析:
本题难度:一般
4、实验题 甲、乙两人分别用不同的方法配制100 mL 3.6 mol/L的稀硫酸。
(1)甲:量取20 mL 18 mol/L浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 mL容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①实验所用的仪器除烧杯和容量瓶外,还有________________________________; ②将溶液转移到容量瓶中的正确操作是____________________________; ③定容的正确操作是________________________。
(2)乙:用100 mL量筒量取20 mL浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 mL刻度线,再搅拌均匀。你认为此法是否正确?若不正确,指出其中错误之处_________________________________________________。
参考答案:(1)①量筒、玻璃棒、胶头滴管;②将玻璃棒插入容量瓶刻度线以下,使溶液沿玻璃棒慢慢地流人容量瓶中;③加水至离刻度线1~2 cm时,改用胶头滴管滴加水至液面与刻度线相切
(2)不正确,不能用量筒配制溶液,不能将水加入浓硫酸中
本题解析:
本题难度:一般
5、选择题 配制一定物质的量浓度的氯化钠溶液,不需要用到的仪器是( )
A.烧杯
B.容量瓶
C.漏斗
D.胶头滴管
参考答案:配制一定物质的量浓度的溶液需要的仪器有:托盘天平、药匙、烧杯、玻璃棒、胶头滴管、容量瓶,
所以不需要的仪器为:漏斗,
故选C.
本题解析:
本题难度:简单