1、选择题 下列属于直接利用太阳能的是
①光-热转换②光-电转换③光—化学能转换④光-生物质能转换
A.①②③
B.①③④
C.①②④
D.①②③④
参考答案:D
本题解析:略
本题难度:简单
2、填空题 硫酸亚锡(SnSO4)可用于镀锡工业.某小组设计SnSO4制备路线为:
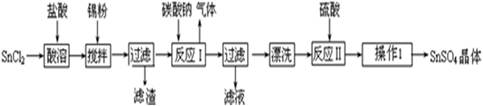
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化.
Ⅱ.SnCl2易水解生成碱式氯化亚锡
(1)锡原子的核电荷数为50,与碳元素同处ⅣA族,锡位于周期表的第?周期(1分)
(2)操作Ⅰ是 ?过滤、洗涤等(2分)
(3)溶解SnCl2粉末需加浓盐酸,原因是??
(4)加入Sn粉的作用有两个:①调节溶液pH?②?
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是?
(6)酸性条件下,SnSO4与双氧水去反应的离子方程式是?
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn+2HCl═SnCl2+H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定②生成的Fe2+,再计算锡粉的纯度,请配平方程式:
FeCl2 +?K2Cr2O7 +?HCl = ?FeCl3 + ?KCl + ?CrCl2+?
参考答案:32.(16分)(1)第五周期(1分);?(2)蒸发浓缩、冷却结晶(2分);
(3)?抑制Sn2+ 的水解(2分);?(4)防止Sn2+ 被氧化(2分);
(5)SnCl2 + Na2CO3=" SnO↓+" CO2↑+ 2NaCl(3分,未写↓和↑符号共扣1分,未配平扣1分)
(6)Sn2+ + H2O2 +2H+ = Sn4 + + 2H2O (3分,未配平扣1分)
(7)③ 6? 1? 14? 6? 2? 2? 7 H2O(3分,化学式H2O给1分,系数全对2分)
本题解析:
试题分析: 解:(1)锡元素与碳元素属于同一主族,处于ⅣA族,原子核电荷数为50,则:50-2-8-8-18=14,故Sn处于第五周期。
(2)由流程图可知,操作Ⅰ是从溶液中得到含结晶水的晶体,只能采取蒸发浓缩、冷却结晶、过滤、洗涤得到。
(3)由信息可知,SnCl2易水解生成碱式氯化亚锡,存在水解平衡SnCl2+H2O Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解。
Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解。
(4)由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;?
(5)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,反应方程式为:SnCl2 + Na2CO3=" SnO↓+" CO2↑+ 2NaCl。
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水,离子方程式为:Sn2++H2O2+2H+═Sn4++2H2O。
(7)反应物中有H元素,所以在酸性条件下生成物必为H2O,所以根据的是电子守恒配平的方程式为:6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O
本题难度:困难
3、填空题 (10分)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸 氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:
氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:
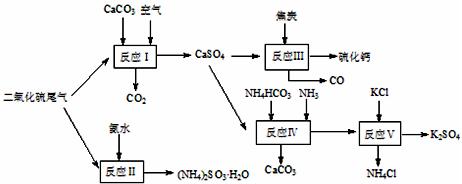
(1)已知对苯二酚是一种强还原剂。生产中,反应Ⅱ中往往需要向溶液 中加入适量的对苯二酚等物质,其目的是? ▲?。
中加入适量的对苯二酚等物质,其目的是? ▲?。
(2)下列有关说法正确的是? ▲?。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C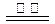 CaS +4CO↑
CaS +4CO↑
C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥