1、实验题 某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为
1.00 mol·L-1、2.00mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验
HNO3的用量为25.0mL、大理石用量为10.00g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号
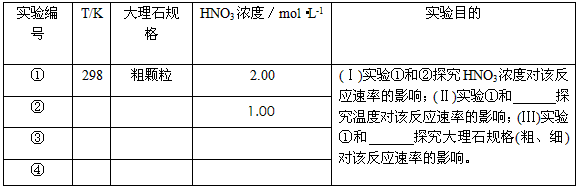
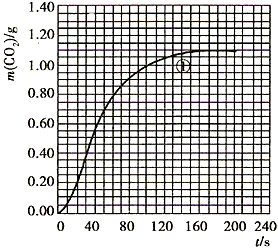
(2)实验①中CO2质量随时间变化的关系见下图
依据反应方程式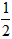 CaCO3+HNO3==
CaCO3+HNO3== Ca(NO3)2+
Ca(NO3)2+ CO2↑+
CO2↑+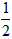 H2O,计算实验①在70~90s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
H2O,计算实验①在70~90s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
参考答案:(1) (2)70至90s内,CO2生成的质量为:m(CO2)=0.95g-0.84g=0.11g,
(2)70至90s内,CO2生成的质量为:m(CO2)=0.95g-0.84g=0.11g,
其物质的量为n(CO2)=0.11g÷44g·mol-1=0.0025mol,
根据方程式比例,可知消耗HNO3的物质的量为:n(HNO3)=0.0025mol×2=0.005mol,
溶液体积为25mL=0.025L,所以HNO3减少的浓度△c(HNO3)=0.2mol·L-1,
所以HNO3在70-90S范围内的平均反应速率为v(HNO3)=0.01mol·L-1·s-1。
本题解析:
本题难度:困难
2、选择题 用纯净的CaCO3与稀HCl反应制CO2,实验过程记录如图所示。根据分析、判断,正确的是
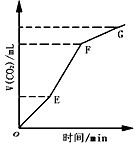
[? ]
A.OE段表示反应速率最快
B.EF段表示反应速率最快,收集的CO2最多
C.FG段表示收集的CO2最多
D.OG段表示随着时间的推移,反应速率逐渐增快
参考答案:B
本题解析:
本题难度:一般
3、选择题 如下图所示a曲线表示一定条件下可逆反应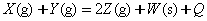 的反应过程。若使a曲线变成b曲线,可采取的措施是(?)。
的反应过程。若使a曲线变成b曲线,可采取的措施是(?)。
A.加入催化剂
B.增加Y的浓度
C.降低温度
D.增大体系压强
参考答案:A、D
本题解析:改变条件后a曲线与b曲线中X的转化率仍相等,说明平衡没有移动。这是一个反应前后分子数相等的反应,因此催化剂与压强不能使平衡移动。
本题难度:一般
4、选择题 下列措施对增大反应速率明显有效的是( )
A.Al在氧气中燃烧生成A12O3,将Al粉改为Al片
B.Fe与稀盐酸反应制取H2时,改用氢离子浓度相同的稀硫酸
C.Zn与稀硫酸反应时,适当提高溶液的温度
D.Na与水反应时增大水的用量
参考答案:A、将Al片改成Al粉,增大了反应物的接触面积,所以能使反应速率加快,故A正确;
B、Fe与稀盐酸反应制取H2时,改用氢离子浓度相同的稀硫酸,氢离子浓度相同,反应速率相同,故B错误;
C、Zn与稀硫酸反应时,适当提高溶液的温度,升高温度能加快化学反应的速率,故C正确;
D、钠和水反应的速率与水的多少无关,故D错误.
故选AC.
本题解析:
本题难度:简单
5、填空题 (4分)将影响反应速率条件的编号填在空格处。
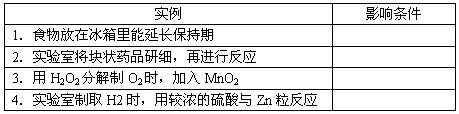
A.温度
B.催化剂
C.固体的表面积
D.溶液的浓度
参考答案:A? C? B? D
本题解析:略
本题难度:简单