1、选择题 下列式子正确的是(? )
A.H×
B.Na×+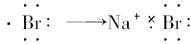
C.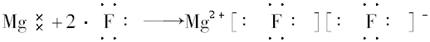
D.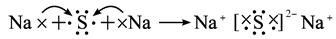
参考答案:D
本题解析:在元素符号周围用·或×来表示元素原子最外层电子的数目,这种式子叫电子式。
从题意看,是检查用电子式表示离子或分子形成的过程。检查时注意:
(1)阴、阳离子是否已标明电荷数;
(2)阴离子必须加括号,表示得到电子;
(3)阴或阳离子相同时不能合并写。
A不正确,因为H不是金属原子,故与氯化合后不是离子化合物,不能用“[?]”表示;B项错在阴离子未用方括号括起,未标出电荷;C项错在相同的阴离子排在一起。D项正确。
本题难度:一般
2、填空题 (14分)现有反应:mA(g)+ B(g) 2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
(1)该反应的△H 0(填“>”或“<”),且m 1(填“>”“=”“<”)。
(2)若加入B(假设容器的体积不变),则A的转化率 ,B的转化率 。(填“增大”“减小”或“不变”)
(3)若B是有色物质,A、C均无色,则加入C(假设容器的体积不变)时混合物颜色 ,
若维持容器内压强不变,充入氖气时,混合物颜色 (填“变深”“变浅”或“不变”)。
(4)一定温度下,向1L密闭容器中加入1mol C(g)使其分解,气体A的物质的量随时间的变化如下图所示。

则0~2 min内的平均反应速率υ(C)= 。
参考答案:(1) <;= (2)增大 减小 (3)变深 变浅 (4) 0.1mol·L-1·min-1
本题解析:(1)达到平衡后,当升高温度时,A的转化率变小;说明温度升高平衡向逆反应方向移动,则正反应放热,逆反应为吸热反应,当减小压强时,混合体系中C的质量分数不变,说明压强减小平衡不移动,则方程式中反应物的气体的计量数之和等于生成物气体的化学计量数之和,故答案为:<、=;
(2)若加入B(假设容器的体积不变)平衡向正反应方向移动A的转化率增大,B的转化率减小。故答案为:增大、减小
(3)加入C时平衡左移颜色加深,维持压强不变,充入氦气容器体积膨胀,气体浓度减小颜色变浅。故答案为:加深、变浅
(4)由图可知反应中A增加了0.1 mol,根据方程式A(g)+ B(g) 2C(g)得C分解了0.2 mol,故则0~2 min内的平均反应速率υ(C)= 0.1mol·L-1·min-1
2C(g)得C分解了0.2 mol,故则0~2 min内的平均反应速率υ(C)= 0.1mol·L-1·min-1
考点:化学反应平衡的移动、化学反应速率的计算。
本题难度:一般
3、选择题 下图为某反应的焓变示意图,下列有关该反应的说法中正确的是
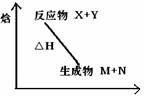
A.△H>0
B.X能量一定高于M
C.该反应一定不必加热就可以发生
D.该反应为放热反应