1、选择题 下列物质中含有共价键的离子化合物是( ?)
①MgF2?②Na2O2③NaOH?④NH4Cl?⑤CO2?⑥H2O2?⑦N2
A.②③④⑤⑦
B.①②③④⑥
C.②③④
D.①③⑤⑥
参考答案:C
本题解析:一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。又因为含有离子键的化合物是离子化合物,全部由共价键形成的化合物是共价化合物,所以含有共价键的离子化合物是②③④。①中只有离子键,⑤⑥⑦中只有共价键,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练。该题的关键是明确化学键与化合物的关系,然后灵活运用即可,有利于培养学生的逻辑思维能力和灵活应变能力。
本题难度:简单
2、选择题 某致基因突变物质的结构简式如图。下列相关分析正确的是
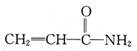
A.电负性:C<N<O
B.该分子中σ键与π键数目之比为4:2
C.该分子所有原子处于同一平面
D.该分子的加聚产物为
参考答案:A
本题解析:A、同周期主族元素,随着原子序数的增大,电负性增大,所以电负性:C<N<O,正确;B、根据结构简式可知,该分子中σ键9个,π键2个,二者数目之比为9:2,错误;C、N原子与周围的原子不在同一平面上,错误;D、加聚后主链为—CH2—CH—,错误。
本题难度:一般
3、选择题 下列有关σ键和π键的说法正确的是
A.σ键是镜像对称,而π键是轴对称
B.π键是由两个p电子“头碰头”重叠形成的
C.σ键可沿键轴自由旋转而不影响键的强度
D.π键比σ键重叠程度大,形成的共价键强
参考答案:C
本题解析:σ键是“头碰头”重叠形成,可沿键轴自由旋转,为轴对称;而π键是由两个p电子“肩并肩”重叠形成,重叠程度小,为镜像对称,据此来解答。A、σ键是轴对称,而π键是镜像对称,故A错误;B、π键是由两个p电子“肩并肩”重叠形成,故B错误;C、σ键为轴对称,可沿键轴自由旋转而不影响键的强度,故C正确;D、π键比σ键重叠程度小,形成的共价键不稳定,故D错误,答案选C。
本题难度:一般
4、选择题 下列反应中,氧化剂与还原剂物质的量的关系为1:2的是
A.N2O+4H2═2NH3+H2O
B.2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)2
C.I2+2NaClO3═2NaIO3+Cl2
D.4HCl+MnO2═MnCl2+Cl2↑+2H2O
参考答案:D
本题解析:分析:所含元素化合价降低的反应物是氧化剂,所含元素化合价升高的反应物是还原剂.
A、反应中氮元素化合价由N2O中+1价降低为NH3中-3价,N2O是氧化剂,氮元素化合价全部降低;氢元素化合价由H2中0价升高为NH3、H2O中+1价,H2是还原剂,氢元素化合价全部升高.根据化学计量数判断.
B、属于复分解反应,不是氧化还原反应.
C、反应中氯元素化合价由NaClO3中+5价降低为Cl2中0价,NaClO3是氧化剂,氯元素化合价全部降低;反应中碘元素化合价由I2中0价升高为NaIO3中+5价,I2是还原剂,碘元素化合价全部升高.结合化学计量数判断.
D、反应4HCl+MnO2═MnCl2+Cl2↑+2H2O中,锰元素化合价由MnO2中+4价降低为MnCl2中+2价,MnO2是氧化剂,锰元素化合价全部降低;反应中氯元素化合价由HCl中-1价升高为Cl2中0价,HCl是还原剂,由方程式产物中氯元素化合价可知有 的HCl起还原剂作用,有
的HCl起还原剂作用,有 的HCl起酸作用,结合化学计量数判断.
的HCl起酸作用,结合化学计量数判断.
解答:A、反应N2O+4H2═2NH3+H2O中,氮元素化合价由N2O中+1价降低为NH3中-3价,N2O是氧化剂,氮元素化合价全部降低;氢元素化合价由H2中0价升高为NH3、H2O中+1价,H2是还原剂,氢元素化合价全部升高,所以氧化剂与还原剂的物质的量之比为1:4,故A错误;
B、属于复分解反应,不是氧化还原反应,不谈氧化剂与还原剂,故B错误;
C、反应I2+2NaClO3═2NaIO3+Cl2中,氯元素化合价由NaClO3中+5价降低为Cl2中0价,NaClO3是氧化剂,氯元素化合价全部降低;反应中碘元素化合价由I2中0价升高为NaIO3中+5价,I2是还原剂,碘元素化合价全部升高,所以氧化剂与还原剂的物质的量之比为2:1,故C错误;
D、反应4HCl+MnO2═MnCl2+Cl2↑+2H2O中,锰元素化合价由MnO2中+4价降低为MnCl2中+2价,MnO2是氧化剂,锰元素化合价全部降低;反应中氯元素化合价由HCl中-1价升高为Cl2中0价,HCl是还原剂,由方程式产物中氯元素化合价可知有 的HCl起还原剂作用,有
的HCl起还原剂作用,有 的HCl起酸作用,所以氧化剂与还原剂的物质的量之比为1:4×
的HCl起酸作用,所以氧化剂与还原剂的物质的量之比为1:4× =1:2,故D正确.
=1:2,故D正确.
故选:D.
点评:考查氧化还原反应基本概念与计算,难度不大,本题根据化学计量数判断氧化剂与还原剂关系,也可以根据电子转移守恒计算,注意D中氯化氢的作用.
本题难度:困难
5、填空题 (8分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。
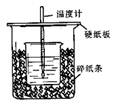
通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
参考答案:17.(8分)(1)环形玻璃搅拌棒 (2)减少实验过程中的热量损失。 (3)偏小
(4)不相等;相等;因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关
(5)偏小;
本题解析:(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,答案为:环形玻璃搅拌器;(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:减少实验过程中的热量损失,答案为:减少实验过程中的热量损失;(3)大烧杯上如不盖硬纸板,会导致热量散失,求得的中和热数值偏小;(4)反应放出的热量和所用酸以及碱的量的多少有关,若用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液反应,测得中和热数值相等,答案为:不相等;相等;因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关;(5)氨水为弱碱,电离过程为吸热过程,所以氨水代替NaOH溶液反应,反应放出的热量小于57.3kJ,答案为:偏小.
考点:考查中和热的测定。
本题难度:一般