1、选择题 将2.24LCO2,(标准状况)通人150mLlmol?L-1NaOH溶液中(溶液体积变化忽略不计),充分反应后,下列对反应后溶液的说法正确的是
A.n(CO32-)+n(HCO3-)=0.1mol
B.c(CO32-)略小于c(HCO3-)
C.c(Na+)=0.15mol?L-1
D.反应后只有一种产物
参考答案:B
本题解析:分析:n(CO2)=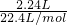 =0.1mol,n(NaOH)=0.15L×1moL/L=0.15mol,二者发生:2CO2+3OH-=CO32-+HCO3-+H2O,CO32-水解程度大于HCO3-,以此解答该题.
=0.1mol,n(NaOH)=0.15L×1moL/L=0.15mol,二者发生:2CO2+3OH-=CO32-+HCO3-+H2O,CO32-水解程度大于HCO3-,以此解答该题.
解答:n(CO2)=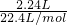 =0.1mol,n(NaOH)=0.15L×1moL/L=0.15mol,二者发生:2CO2+3OH-=CO32-+HCO3-+H2O,则
=0.1mol,n(NaOH)=0.15L×1moL/L=0.15mol,二者发生:2CO2+3OH-=CO32-+HCO3-+H2O,则
A.溶液中存在CO32-、HCO3-、H2CO3,根据物料守恒,应有n(CO32-)+n(HCO3-)+n(H2CO3)=0.1mol,故A错误;
B.由反应方程式可知,反应生成等物质的量的CO32-和HCO3-,CO32-水解程度大于HCO3-,且生成HCO3-,则c(CO32-)略小于c(HCO3-),故B正确;
C.根据Na元素守恒,由于溶液体积不变,则c(Na+)=c(NaOH)=1mol?L-1,故C错误;
D.由反应方程式可知,反应生成等物质的量的CO32-和HCO3-,为Na2CO3和NaHCO3的混合物,故D错误.
故选B.
点评:本题考查混合物反应的计算和判断,解答本题时,可根据反应物的物质的量关系快速写出反应的化学方程式,是计算的一种很好的方法,同学们可借鉴.
本题难度:一般
2、选择题 人类使用和制造材料有着悠久的历史,人类制造的第一种材料是
A.红宝石
B.陶瓷
C.金刚石
D.水泥
参考答案:B
本题解析:红宝石和金刚石是天然材料,近期才研究人工制造;水泥的制造比陶瓷要晚得多。
本题难度:一般
3、选择题 对汽车尾气的处理有人提出下列做法:在马路上铺设“光触媒”(如二氧化钛)物质,将空气中的氮氧化物、一氧化碳、二氧化硫等污染物在催化剂表面转化、分解成对人体、环境基本无害的物质.下列有关说法正确的是
A.此法可将汽车尾气中的CO在催化剂表面氧化生成CO2
B.此法可将汽车尾气中的NOx在催化剂表面氧化生成N2
C.此法可将汽车尾气中的二氧化硫还原成三氧化硫
D.此法是解决城市空气污染的唯一途径
参考答案:A
本题解析:分析:由题意“将空气中的氮氧化物、一氧化碳、二氧化硫等污染物在催化剂表面转化、分解成对人体、环境基本无害的物质”,则可知:该过程可将一氧化碳氧化为二氧化碳,可将氮氧化物转化为氮气或硝酸盐,可将二氧化硫转化为硫酸盐.
解答:A.此法可将汽车尾气中的CO氧化生成CO2,故A正确;
B.此法可将汽车尾气中的氮氧化物在催化剂表面转化为N2或硝酸盐,不一定生成氮气,故B错误;
C.此法可将汽车尾气中的二氧化硫氧化成三氧化硫,故C错误;
D.此法不是解决城市空气污染的唯一途径,故D错误.
故选A.
点评:本题考查常见的生活环境的污染及治理,难度不大,平时注意知识的积累.
本题难度:困难
4、选择题 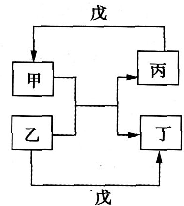 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是
A.A
B.B
C.C
D.D
参考答案:B
本题解析:分析:根据反应甲+乙→丙+丁,丙+戊→甲,乙+戊→丁分析,结合物质的性质判断这两个反应是否能发生,如果能发生,则正确,否则错误.
解答:A.铜和氯化铁反应生成氯化亚铁和氯化铜,氯化铜和铁反应生成铜,氯化铁和铁反应生成氯化亚铁,所以能实现转化,故A正确;
B.水和钠反应生成氢气和氢氧化钠,氢气在氧气中燃烧生成水,钠和氧气反应生成氧化钠或过氧化钠而不是氢氧化钠,所以不能实现转化,故B错误;
C.氢氧化铝和盐酸反应生成氯化铝和水,氯化铝和氨水反应生成氢氧化铝沉淀,盐酸和一水合氨反应生成氯化铵,所以能实现转化,故C正确;
D.乙醇和氧气反应生成乙醛和水,乙醛和氢气发生加成反应生成乙醇,氢气在氧气中燃烧生成水,所以能实现转化,故D正确;
故选B.
点评:本题考查常见物质的性质,明确物质的性质是解本题关键,可以采用代入法解答,注意氢氧化铝能溶于强碱,但不能溶于弱碱,为易错点.
本题难度:困难
5、选择题 要使氯化铝中的铝离子完全转化成氢氧化铝沉淀,应选的最佳试剂
A.氢氧化钠溶液
B.稀盐酸
C.氨水
D.硝酸银溶液
参考答案:C
本题解析:分析:若使Al3+全部生成氢氧化铝沉淀,可以和碱反应,也可以和水解显碱性的盐反应;
Al(OH)3是两性氢氧化物能溶于强酸和强碱,Al3+离子全部沉淀需要所加的试剂过量,所以全部沉淀Al3+最好不用强碱,一般选择用弱碱,如氨水溶液.
解答:A、氢氧化钠溶液是强碱溶液,沉淀Al3+时生成的氢氧化铝能溶解在过量的强碱溶液中,所以Al3+不能全部沉淀出来,故A错误;
B、稀盐酸不与氯化铝反应,故C错误;
C、氨水是弱碱溶液,可以加入过量氨水,全部沉淀Al3+,且Al(OH)3不溶于弱碱氨水溶液,故C正确;
D、硝酸银溶液不能和氯化铝反应生成氢氧化铝,故D错误;
故选C.
点评:本题考查了铝盐、氢氧化铝的性质应用,重点考查氢氧化铝的实验室制备,注意氢氧化铝是两性强氧化物,本题难度适中.
本题难度:一般