1、选择题 电解无水氯化镁所得的镁蒸气冷却后即为固体镁。下列气体中,镁蒸气可以在其氛围中冷却的是
A.H2
B.CO2
C.空气
D.O2
参考答案:A
本题解析:镁属于活泼的金属,在加热的条件下,能和CO2、空气和氧气都反应,属于应该选择氢气,答案选A。
本题难度:一般
2、选择题 物质循环利用是绿色化学对化工生产的基本要求.工业生产中物质的循环利用有多种模式.例如:
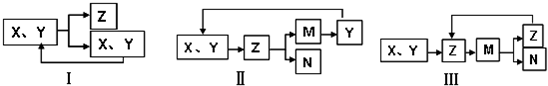
下列表述不正确的是
A.图Ⅰ可表示合成氨,其中N2、H2被循环使用
B.图Ⅱ可表示电解熔融的MgCl2得到镁,其中HCl循环使用
C.图Ⅲ可表示氨催化氧化法制硝酸,其中NO循环使用
D.图Ⅰ可用于侯氏制纯碱CO2的循环利用
参考答案:D
本题解析:分析:A、图Ⅰ若是工业合成氨,反应是化学平衡,不能进行彻底,原料气可以循环利用;
B、海水提取得到氢氧化镁和盐酸反应生成氯化镁,浓缩蒸发得到氯化镁固体,电解得到金属镁和氯气,氯气和氢气反应生成氯化氢可以循环利用;
C、图Ⅲ可表示氨催化氧化法制硝酸时,氨气和氧气催化氧化为一氧化氮,一氧化氮氧化为二氧化氮,二氧化氮溶于水生成硝酸和一氧化氮,一氧化氮可以循环利用;
D、图Ⅰ可用于侯氏制纯碱时,是氨化的饱和氯化钠溶液中通入氨气生成碳酸氢钠晶体和氯化铵,无CO2的循环利用.
解答:A、图Ⅰ若是工业合成氨,反应是化学平衡,不能进行彻底,原料气氮气和氢气可以循环利用,故A正确;
B、海水提取得到氢氧化镁和盐酸反应生成氯化镁,浓缩蒸发得到氯化镁固体,电解得到金属镁和氯气,氯气和氢气反应生成氯化氢可以循环利用,故B正确;
C、图Ⅲ可表示氨催化氧化法制硝酸时,氨气和氧气催化氧化为一氧化氮,一氧化氮氧化为二氧化氮,二氧化氮溶于水生成硝酸和一氧化氮,一氧化氮可以循环利用,故C正确;
D、图Ⅰ可用于侯氏制纯碱时,是氨化的饱和氯化钠溶液中通入氨气生成碳酸氢钠晶体和氯化铵,无CO2的循环利用,故D错误;
故选D.
点评:本题考查了物质的循环利用有的多种模式,物质转化关系,工业制备的流程,反应原理的应用,主要是工业合成氨、海水提取镁、氨的催化氧化制硝酸、候氏制碱的生产原理和反应特征的熟练掌握,题目较综合,难度较大,需要熟练掌握工业制备的流程.
本题难度:简单
3、选择题 下述对乙烯和聚乙烯的描述不正确的是
A.乙烯性质比聚乙烯活泼
B.乙烯是纯净物,常温下为气态,聚乙烯为固态,是混合物
C.取等物质的量的乙烯和聚乙烯,完全燃烧,生成的CO2和H2O的物质的量分别相等
D.取等质量乙烯和聚乙烯,完全燃烧后,生成的CO2和H2O的质量分别相等
参考答案:C
本题解析:乙烯中含有碳碳双键,聚乙烯中不含双键,所以乙烯性质活泼;聚乙烯的聚合度不确定,是一种混合物;乙烯和聚乙烯的组成相同,所以取等质量乙烯和聚乙烯,完全燃烧后,生成的CO2和H2O的质量分别相等;但是等物质的量的乙烯和聚乙烯,完全燃烧,生成的CO2和H2O不相同,聚乙烯因为乙烯的n倍(n为聚乙烯的聚合度).
本题难度:困难
4、选择题 用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是
①加盐酸溶解?
②加烧碱溶液溶解?
③过滤
④通入过量CO2生成Al(OH)3沉淀
⑤加入盐酸生成Al(OH)3?沉淀?
⑥加入过量烧碱溶液
A.①⑥⑤③
B.②③④③
C.②③⑤③
D.①③⑤③
参考答案:B
本题解析:镁能和盐酸反应,但和氢氧化钠不反应。而铝能和氢氧化钠溶液反应,所以正确的答案选B。
本题难度:困难
5、选择题 一定体积0.01 mol/L的稀硝酸溶液恰好能氧化一定质量的铁、铝混合物,已知两种金属均被氧化为最高价态,还原产物只有NO。若用0.01 mol/L NaOH溶液溶解相同质量的该混合物,当反应完全时所需氢氧化钠溶液的体积是稀硝酸溶液的1/5,则样品中铁、铝的物质的量之比为
A.1∶4
B.1∶3
C.2∶3
D.5∶3
参考答案:A
本题解析:试题分析:铁不与NaOH溶液反应,铝与NaOH溶液反应,铁、铝都可以与稀硝酸反应,假设消耗稀硝酸的体积为VL,稀硝酸的物质的量为0.01Vmol,则NaOH溶液消耗的体积为1/5 VL,根据Al~NaOH,Al的物质的量为0.002Vmol,Al~4HNO3,消耗HNO3的物质的量为0.008Vmol,Fe消耗的硝酸为0.01Vmol-0.008Vmol=0.002Vmol,Fe~4HNO3,Fe的物质的量为0.0005Vmol,故样品中铁、铝的物质的量之比为1∶4。故选A。
考点:有关混合物反应的计算
点评:本题结合镁铜与硝酸反应、生成的盐与氢氧化钠反应,综合考查学生的得失电子守恒、质量守恒的综合计算能力,同时也考查了学生的学习综合运用和解决复杂问题的能力,是一道考查能力的好题,难度较大。
本题难度:简单