1、选择题 下列措施一定能使化学反应速率加快的是( )
A.增大反应物的量
B.增大压强
C.升高温度
D.使用催化剂
参考答案:C
本题解析:A、增大固体或纯液体反应物的量,对化学反应速率无影响,错误;B、对于没有气体参加的反应,增大压强对化学反应速率无影响,错误;C、升高温度,化学反应速率一定加快,正确;D、使用正催化剂,化学反应速率加快,使用负催化剂,化学反应速率减慢,错误。
本题难度:一般
2、填空题 在下列事实中,什么因素影响了化学反应的速率?
(1)黄铁矿煅烧时要粉碎成细小的矿粒:________;
(2)熔化的KClO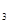 放出气泡很慢,加入少量MnO
放出气泡很慢,加入少量MnO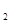 很快产生气体:________;
很快产生气体:________;
(3)同浓度、同体积的盐酸中放入大小相同的铁片和镁片产生气体有快有慢:________;
(4)同样大小的石灰石分别在0.1mol/L的盐酸和1mol/L的盐酸中反应速率不同:________________;
(5)夏天的食品易霉变,冬天就不易发生类似现象:________。
参考答案:(5分)(1)固体表面积(2)催化剂(3)物质的性质(4)溶液的浓度(5)温度
本题解析:可以根据影响化学反应速率的因素方面进行分析、判断,从而得出正确的结论。
(1)黄铁矿煅烧时要粉碎成细小的矿粒,可以增大反应物的接触面积,加快反应速率。
(2)熔化的氯酸钾放出气泡很慢,若加入少量Mn02时分解加速,说明化学反应速率受催化剂的影响。
(3)同浓度、同体积的盐酸中放入同样大小的碳粒和镁条,产生气体有快有慢,这说明影响化学反应速率的因素是反应物自身的性质。
(4)同样大小的石灰石分别在0.1mol·L-1的盐酸和1mol·L-1的盐酸中,反应速率不同,这是由于盐酸的浓度不同引起的,反应物的浓度越大,反应速率越快。
(5)夏天的食品易霉变,冬天就不易发生该现象,这是由于夏天气温高,故食品易霉变,而冬天气温低不易发生该现象,因此温度高低对反应速率有影响,温度越高反应速率越快。
点评:该题是基础性试题的考查,难度不大。明确反应速率的含义以及影响因素是答题的关键。因此解答本题时要充分理解影响化学反应速率的因素,然后才能对问题做出正确的判断。
本题难度:一般
3、选择题 下列做法的目的与反应速率有关的是( )
A.用冰箱冷藏食物
B.在糖果制作过程中添加着色剂
C.向食盐中添加碘酸钾
D.在化学反应中加入合适的催化剂
参考答案:A.用冰箱冷藏食物可降低食物变质的速率,与反应速率有关,故A正确;
B.在糖果制作过程中添加着色剂,为改变糖果的颜色,与反应速率无关,故B错误;
C.向食盐中添加碘酸钾,可减少人体缺碘而导致的大脖子病,与反应速率无关,故C错误;
D.在化学反应中加入合适的催化剂,可改变反应速率,与反应速来源:91考试网 91EXAm.org率有关,故D正确.
故选AD.
本题解析:
本题难度:简单
4、填空题 KI溶液在酸性条件下能与氧气反应。现有以下实验记录:
实验编号
| ①
| ②
| ③
| ④
| ⑤
|
温度(℃)
| 30
| 40
| 50
| 60
| 70
|
显色时间(s)
| 160
| 80
| 40
| 20
| 10
|
回答下列问题:
(1)该反应的离子方程式为?。
(2)该实验的目的是?。
(3)实验试剂除了1 mol/L KI溶液、0.1 mol/L H2SO4溶液外,还需要的试剂是?,实验现象为?。
(4)上述实验操作中除了需要(3)的条件外,还必须控制不变的是?(填字母)。
A.温度?B.试剂的浓度 ?C.试剂的用量(体积) ?D.试剂添加的顺序
(5)由上述实验记录可得出的结论是?。
(6)若要进行酸性对反应速率的影响的探究实验,你会采取的措施是?。
参考答案:(1)4H+ + 4I- + O2= 2I2+ 2H2O?(3分)
(2)探究温度对反应速率的影响。(探究温度与溶液显色时间的关系)(2分)
(3)淀粉溶液(2分)?无色溶液变蓝色。(2分)
(4)CD (2分)
(5)每升高10℃,反应速率增大约2倍。(2分,若回答其他条件不变,温度越高,化学反应速率越快或溶液显色时间越短给1分)
(6)保持其他实验条件不变,采用不同浓度的硫酸溶液进行对比实验。(2分)
本题解析:本题以KI溶液在酸性条件下与氧气的反应为载体,提高实验探究温度等外界条件对化学反应速率的影响规律,设计实验必须保证其他条件不变,只改变一个条件,才能得到准确的结论。(1)根据氧化还原反应类型离子方程式要遵循原子守恒、电荷守恒和得失电子数目相等,该反应的离子方程式为4H+ + 4I- + O2= 2I2+ 2H2O;(2)根据表中数据分析,该实验目的是探究温度对反应速率的影响;(3)为测定显色时间,产物中有碘单质生成,还需要的试剂是淀粉溶液,实验现象为无色溶液变蓝色;(4)设计实验必须保证其他条件不变,只改变一个条件,才能得到准确的结论,还必须控制不变的是试剂的用量(体积) 和试剂添加的顺序,选CD;(5)分析实验数据可得出的结论是每升高10℃,反应速率增大约2倍。(6)若要进行酸性对反应速率的影响的探究实验,你会采取的措施是保持其他实验条件不变,采用不同浓度的硫酸溶液进行对比实验。
本题难度:一般
5、选择题 对已经达到化学平衡的2X(g)+Y(g) 2Z(g)减小压强时,对反应的影响是(?)
2Z(g)减小压强时,对反应的影响是(?)
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
参考答案:C
本题解析:减小压强时,正逆反应速率都减小,并且气体化学计量数大的一方,改变的程度大,因此平衡逆向移动。选C。
本题难度:一般