1、实验题 某化学兴趣小组要完成中和热的测定。(13分)
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol· L-1盐酸、0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是?、?。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?
?(填“能”或“否”),其原因是?。
(3)他们记录的实验数据如下:
实 验 用 品
| 溶 液
温 度
| 中和热
△H
|
t1
| t2
|
①
| 50mL 0.55mol.L-1NaOH
| 50mL 0.5mol.L-1HCl
| 20℃
| 23.3℃
| ?
|
②
| 50mL 0.55mol.L-1NaOH
| 50mL 0.5mol.L-1HCl
| 20℃
| 23.5℃
|
已知:Q=cm(t2 -t1),反应后溶液的比热容c为4.18J·℃-1· g-1,各物质的密度均为1g·cm-3。
根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式(△H值精确到小数点后2位):
?(4)若用KOH代替NaOH,对测定结果?(填“有”或“无”)影响。
参考答案:(13分)
(1)量筒?温度计(4分)
(2)否?铜丝导热性良好,会对中和热的计算造成影响(4分)
(3)NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)? ΔH=-56.85 kJ·mol-1
(4)无(2分)
本题解析:实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol· L-1盐酸、0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是量筒?温度计;实验中不能用环形铜丝搅拌棒代替环形玻璃搅拌棒,因为铜丝导热性良好,会对中和热的计算造成影响;已知:Q=cm(t2 -t1),反应后溶液的比热容c为4.18J·℃-1· g-1,各物质的密度均为1g·cm-3;NaOH溶液与HCl溶液反应的热化学方程式是NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)? ΔH=-56.85 kJ·mol-1
若用KOH代替NaOH,对测定结果无影响,因为二者均是强碱。
点评:中和热是指H+ (aq) +? OH- (aq)? =? H2O (l)?反应的放热(要求强酸强碱的稀溶液),如果使用弱酸或弱碱,那么它们电离出H+、OH-时会吸热,所以会使测得的中和热的数值偏低;部分强酸、强碱(例浓硫酸)的浓溶液稀释时会放热,所以会使测得的中和热的数值偏高。
本题难度:一般
2、选择题 H2在O2中燃烧生成气态H2O的反应是一个放热反应,在反应过程中( )
A.核能转化为热能
B.化学能转化为热能
C.生成物的总能量等于反应物的总能量
D.生成物的总能量大于反应物的总能量
参考答案:A、H2在O2中燃烧生成水是会放出热能,是由于化学能转化为热能,不是核能的转化,故A错误;
B、H2在O2中燃烧生成水是会放出热能,是由于化学能转化为热能,故B正确;
C、放热反应中生成物的总能量不可能等于反应物的总能量,故C错误;
D、放热反应中反应物的总能量高于生成物的总能,故D错误;
故选:B.
本题解析:
本题难度:简单
3、选择题 已知:2H2(g)+O2(g)=2H2O(l)? ;
;
CH4 (g)+2O2(g)=CO2+2H2O(l)?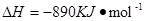 ;
;
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3241.6KJ。则原混合气体中H2与CH4的物质的量之比是((?)
A.2∶3
B.1∶3
C.1∶1
D.1∶4
参考答案:A
本题解析:H2与CH4的混合气体112L(标准状况)即为5mol,设混合气体中n(H2)为Xmol,反应放出的热量为Y kJ, 那么n(CH4)为(5-X)mol,根据热化学方程式可列方程
2:571.6=X:Y
1:890=(5-X):(3241.6-Y)
解此方程组,可得X,进而可求得X:(5-X)=2:3
本题难度:简单
4、填空题 (8分)2SO2(g)+ O2(g) 2SO3(g)?△H =" a" kJ·mol-1,反应过程的能量变化如图所示。
2SO3(g)?△H =" a" kJ·mol-1,反应过程的能量变化如图所示。

已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:
⑴图中A点表示_________________,a=__________。
⑵Ea的大小对该反应的△ H _______(填“有”或“无”)影响。该反应常用V2O5作催化剂,加入V2O5会使图中B点___________(填“升高”、“降低”或“不变”)。
H _______(填“有”或“无”)影响。该反应常用V2O5作催化剂,加入V2O5会使图中B点___________(填“升高”、“降低”或“不变”)。
⑶已知单质硫的燃烧热为296kJ·mol-1,写出反应的热化学方程式:__?__,常温常压下,由单质硫和氧气经两步反应,生成3 mol SO3(g),放出的总热量为___?_。
参考答案:
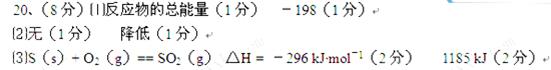
本题解析:略
本题难度:一般
5、选择题 将1mol?A(g)和2mol?B(g)置于2L某密闭容器中,在一定温度下发生反应:A(g)+B(g)?C(g)+D(g),并达到平衡.C的体积分数随时间变化如下图I中曲线b所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是( )

A.反应在第4秒钟达到化学平衡状态,0~4秒内,以A表示的化学反应速率是0.225mol?L-1?s-1
B.该温度下,反应的平衡常数数值约为7.36
C.恒温条件下,缩小反应容器体积可以使反应?的过程按图I中a曲线进行
D.在上述反应体系中加入催化剂,化学反应速率增大,E1和E2均减小
参考答案:A、根据反应方程式的化学计算量数关系可知,VA=VC=3×0.3mol2L4S=0.1125mol?L-1?s-1,故A错误;
B、A(g)+B(g)?C(g)+D(g),
开始1mol? 2mol? 0? 0
反应0.9mol? 0.9mol?0.9mol0.9mol?
平衡0.1mol? 1.1mol 0.9mol0.9mol?
K=CC.CDCA.CB=0.9mol×0.9mol?0.1mol?×?1.1mol?=7.36,故B正确;
C、缩小反应容器的体积,压强增大,反应速率增大,方程式中气体的化学计量数反应前后相等,增大压强平衡不移动,故C正确;
D、加入催化剂降低反应的活化能,则E1和E2均减小,化学反应速率增大,故D正确;
故选A.
本题解析:
本题难度:简单