1、推断题 下图中的B~K分别代表有关反应的一种反应物或生成物,其中A、C、F、K是固体;E是常见的气体单质而I是红棕色的气态氧化物。固态物质A加热后生成的气体混合物若通过碱石灰只剩余气体B,若通过浓硫酸则只剩余气体D。各物质间的转化关系如下图所示

请回答下列问题
(1)写出实验室检验A物质中含有的阳离子的方法________________。
(2)B与E反应得到1molH,则此时转移电子的物质的量为_____________mol。
(3)写出实验室制取B的化学方程式_____________________________。
(4)写出N的稀溶液与过量的铁粉反应的离子方程式_____________________________。
(5)若混合气体通过碱石灰得到的气体B与通过浓硫酸得到的气体D的物质的量之比是8∶5,则用物质的量的关系表示此固体A的组成为_______________________。
参考答案:(1)取适量A物质放入试管中,加入适量NaOH等强碱溶液并加热,若能产生使湿润的红色石蕊试纸变蓝的气体,则证明含有铵根离子
(2)5
(3)Ca(OH)2+2NH4Cl CaCl2+2H2O+2NH3↑
CaCl2+2H2O+2NH3↑
(4)3Fe+8H++2NO3-==2NO↑+3Fe2++4H2O
(5)NH4HCO3和(NH4)2CO3按物质的量之比为2:3混合而成
本题解析:
本题难度:困难
2、填空题 (12分)根据下列框图关系填空。已知反应①、③是工业生产中的重要反应,D、E常温下为气体、X常温下为五色液体,H与E相对分子质量之间的关系为:Mr(H)-Mr(E)=34,又知C的焰色反应呈黄色。
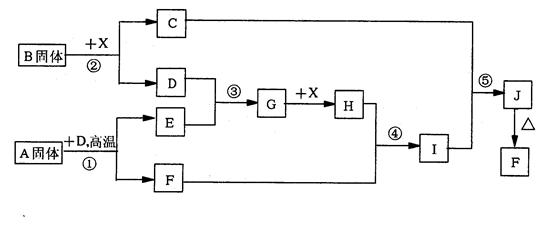
(1)化合物B中所包含的化学键有___________________
(2)反应④的离子方程式:________________________________
反应⑤的化学方程式:________________________________
(3)已知每生成16gE,放出106.5kJ热量,则反应①的热化学方程式为:
参考答案:______________________________________?(1)离子键、非极性键(或共价键)?
(2)Fe203+6H+=2Fe3++3H20,? Fe2(S04)3+6NaOH =2Fe(OH)3↓+3Na2S04
(3)FeS2(s)+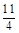 ?02=
?02=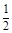 Fe2O3 (s) +2SO2(g);△H=-852kJ/mol
Fe2O3 (s) +2SO2(g);△H=-852kJ/mol
(未注明状态扣1分,写成FeS给2分)
本题解析:本题是无机框图题,根据是找准突破点。C的焰色反应呈黄色,说明含有钠元素。X是液体,所以X是水。反应①、③是工业生产中的重要反应,因此可能是工业制取硫酸的,即A是FeS2,D是氧气,F是氧化铁,E是SO2。所以B是过氧化钠,C是氢氧化钠,G是三氧化硫,H是硫酸,则I是硫酸铁,J是氢氧化铁。
本题难度:一般
3、简答题 在如图所示转化关系中,A是一种固体单质,E是一种白色沉淀,F为密度最小的无色气体.且各种物质所含元素除H、O外,其余均为第三周期元素.
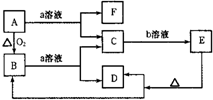 请按要求回答下列问题:
请按要求回答下列问题:
(1)若实现C→E转化所需的b溶液是“过量的盐酸”,则:B的化学式为______,属于______晶体.
(2)若实现C→E转化所需的b溶液为盐酸,但E能被过量的盐酸溶解,则:C→E的离子方程式为______;A和a溶液反应,若产生标准状态下3.36L的F气体,转移的电子数目为______个.
(3)若实现C→E转化所需的b溶液是“过量的NaOH溶液”,则:E的化学式为______;反应B+a→C+D的离子方程式为______.
参考答案:A是一种固体单质,E是一种白色沉淀,F为密度最小的无色气体判断为H2.且各种物质所含元素除H、O外,其余均为第三周期元素,由反应转化关系可知E受热分解生成B+D;B为氧化物a溶液可以是酸溶液或碱溶液;b溶液可以对应是碱溶液或酸溶液;A+a=F+C是置换反应;
(1)b溶液是“过量的盐酸”,生成白色沉淀的物质为硅酸,C为硅酸盐,推断A为Si,B为SiO2,a溶液为强碱溶液如NaOH溶液;二氧化硅晶体属于原子晶体,
故答案为:SiO2;原子;
(2)实现C→E转化所需的b溶液为盐酸,但E能被过量的盐酸溶解,说明C为偏铝酸盐溶液,E为Al(OH)3;A为Al,B为Al2O3,a溶液为强碱溶液如NaOH;C→E的离子方程式为H++AlO2-+H2O=Al(OH)3↓;A和a溶液反应,化学方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,若产生标准状态下3.36L的F气体H2,物质的量=3.36L22.4L/mol=0.15mol,转移的电子数目为:2Al~3H2~6e-,计算得到0.15mol氢气生成单质转移0.3mol,电子数为0.3NA,
故答案为:H++AlO2-+H2O=Al(OH)3↓;0.3NA;
(3)若实现C→E转化所需的b溶液是“过量的NaOH溶液”,判断E沉淀可以是Mg(OH)2;A为Mg,B为MgO,C为Mg2+,D为H2O,F为Mg(OH)2;
反应B+a→C+D的离子方程式为:MgO+2H+=Mg2++H2O,故答案为:Mg(OH)2;MgO+2H+=Mg2++H2O.
本题解析:
本题难度:一般
4、简答题 已知A、B为气体单质,其中A为黄绿色气体,B为无色气体;C为化合物,其水溶液的pH小于7;D为金属单质,它们之间有下列转化关系:

(1)试写出A、B、C、D的化学式:
A______;B______;C______;D______.
(2)写出C的水溶液与D反应的离子方程式:______;
E溶液与A反应的离子方程式:______;
F+D反应的离子方程式:______.
参考答案:A、B为气体单质,其中A为黄绿色气体,B为无色气体;C为化合物,其水溶液的pH小于7,则A为Cl2,B为H2,C为HCl;D为金属单质,结合E与氯气反应,D与F反应,则D为变价金属,则D为Fe,所以E为FeCl2,F为FeCl3,
(1)由上述分析可知,A为Cl2,B为H2,C为HCl,D为Fe,故答案为:Cl2;H2;HCl;Fe;?
(2)C的水溶液与D反应的离子方程式为2H++Fe=H2↑+Fe2+,E溶液与A反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,F+D反应的离子方程式为2Fe3++Fe=3Fe2+,
故答案为:2H++Fe=H2↑+Fe2+;2Fe2++Cl2=2Fe3++2Cl-;2Fe3++Fe=3Fe2+.
本题解析:
本题难度:一般
5、填空题 (14分)已知A、B、C、D、E是短周期中的五种非金属元素,它们的原子序数依次增大。五种元素中A元素原子半径最小;B原子的最外层电子数是内层电子数的2倍;E元素与D元素同主族;E的单质为黄色固体,自然界中游离态的E常出现在火山口附近。
(1)请写出元素符号:B?;D?。
(2)画出E的阴离子结构示意图?。
(3)B、C两种元素对应的最高价含氧酸的酸性较强的是?(填化学式)。
(4)A元素的单质和C元素的单质在一定条件下反应,生成化合物X。 X 的电子式为?,向X的水溶液中滴入石蕊试液,会观察到的现象是?。
(5)用电子式表示化合物BD2的形成过程?。
(6)向苛性钠溶液中通入过量的A2E气体时,所发生反应的离子方程式为?。
(7)化合物ED2与氯 气的水溶液充分反应可生成两种强酸,该反应的化学方程式
气的水溶液充分反应可生成两种强酸,该反应的化学方程式
为??。
参考答案:(14分)
(1)C(1分)? O?(1分)
(2)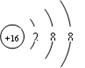 (1分)
(1分)
(3)HNO3(1分)
(4)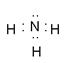 ?(2分)?紫色石蕊试液变蓝(2分)
?(2分)?紫色石蕊试液变蓝(2分)
(5)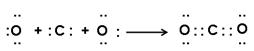 (2分)
(2分)
(6)H2S+OH-=HS-+H2O(2分)
(7)SO2+Cl2+2H2O=H2SO4+2HCl(2分)
本题解析:略
本题难度:一般