|
高中化学知识点归纳《化学反应与能量》高频考点巩固(2020年模拟版)(二)
2020-08-23 07:48:03
【 大 中 小】
|
1、选择题
A.920 kJ
B.557 kJ
C.436 kJ
D.188 kJ
参考答案:C
本题解析:由题意可写出热化学方程式:2 H2(g) + O2(g) = H2O(l);DH =-484kJ/ mol。其中反应物2 =-484kJ/ mol。其中反应物2 mol H2有2 mol H—H键,1 mol O2有1 mol O=O键,生成物中有4 mol H—O键,则1 mol H—H键断裂时吸收热量为 mol H2有2 mol H—H键,1 mol O2有1 mol O=O键,生成物中有4 mol H—O键,则1 mol H—H键断裂时吸收热量为
本题难度:一般
2、选择题 下列说法正确的是
A.在101 kPa时,1 mol H2完全燃烧生成气态水,放出285.8 kJ热量,H2的燃烧热为-285.8 kJ·mol-1
B.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度
C.在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ·mol-1
D.在稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.31 kJ·mol-1。若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ
|
参考答案:B
本题解析:A中没有指明温度,错误;测定中和热是需要测量盐酸起始温度,NaOH起始温度和反应后终止温度,B对;燃烧热是指在25℃,101 kPa时,1mol可燃物完全燃烧生成稳定的氧化物所放出的热量,1 mol C与适量O2反应生成1 mol CO时,没有完全燃烧,故放出的热量不是燃烧热,C错;浓硫酸溶解时要放出热量,故0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ,D错。
考点:燃烧热、中和热的定义的理解。
本题难度:一般
3、选择题 下列各组物质中,全部以共价键结合的是( )
A.Na2S、MgO、HCl
B.NaOH、CaO、N2
C.CO2、H2O、Na2O
D.H2S、NH3、CO2
参考答案:A、Na2S、MgO中含有离子键,HCl中只有共价键,故A错误.
B、CaO中只含离子键,NaOH中既含离子又含共价键,N2中只有共价键,故B错误;
C、Na2O中只含离子键,CO2、H2O中只有共价键,故C错误;
D、H2S、NH3、CO2中只含共价键,故D正确;
故选:D.
本题解析:
本题难度:简单
4、填空题 2SO2(g)+O2 (g)= 2SO3 (g),反应过程的能量变化如图所示。已知:1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ/mol。
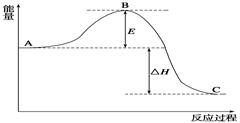
请回答下列问题:
(1)图中A、C分别表示?、 ?,E的大小对该反应的反应热有无影响? ?。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低??,理由是?;
(2)图中ΔH= ?kJ/mol;
(3)如果反应速率v(SO2)为0.05 mol/(L·min),则v(O2)= ?mol/(L·min);
(4)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH(要求计算过程)。
参考答案:(1)反应物能量?生成物能量?没有影响?降低?因为催化剂改变了反应历程, 使活化能E降低?(2)-198?(3)0.025?
(4)S(s)+O2(g)=SO2 (g)? ΔH1=-296 kJ/mol?①
SO2(g)+ O2(g)=SO3(g)?ΔH2=-99 kJ/mol?②
①×3+②×3得 3S (s)+ O2 (g)=3SO3(g) ?ΔH=(ΔH1+ΔH2)×3=-1185 kJ/mol
本题解析:(1)根据图像可知,图中A、C分别表示反应物能量和生成物能量。E为活化能,与反应热无关,但使用催化剂可以降低活化能。
(2)图中表示的是2molSO2的反应,因此△H=-99×2kJ/mol=-198 kJ/mol.
(3)依据速率之比等于化学计量数之比可知,v(O2)=0.05 mol/(L·min)÷2=0.025 mol/(L·min).
(4)S(s)+O2(g)=SO2 (g)? ΔH1=-296 kJ/mol?①
SO2(g)+ O2(g)=SO3(g)?ΔH2=-99 kJ/mol?②
根据盖斯定律可知①×3+②×3得 3S (s)+ O2 (g)=3SO3(g)
所以该反应的反应热ΔH=(ΔH1+ΔH2)×3=-1185 kJ/mol
点评:该题是中等难度的试题,试题贴近高考,基础性强。侧重对学生基础知识的巩固和训练,旨在培养学生灵活运用基础知识解决实际问题的能力。该题的关键是明确影响反应热大小的因素,以及计算依据,如何结合图像灵活运用即可。
本题难度:一般
5、填空题 (10分)已知:H2(g)+O2(g)=H2O(g),反应过程中能量变化如图所示:
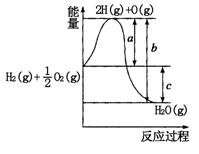
请回答下列问题:
(1)a、b、c分别代表的意义
a. ,
b. ,
c. ;
(2)该反应是 反应(填“放热”或“吸热”),ΔH 0(填“>”、“<”或“=”);
(3)若已知2H2 (g)+O2(g)=2H2O(g) ΔH1=-Q1kJ·mol-1;
2H2 (g)+O2(g)=2H2O(l) ΔH2=-Q2kJ·mol-1,
则ΔH1 ΔH2,Q1 Q2(填“>”“<”或“=”)。
参考答案:(10分)
(1)
a.破坏1molH2和1/2mol O2中化学键所吸收的能量 (2分)
b.由2mol H和1mol O形成1mol H2O(g)所放出的能量 (2分)
c.反应热 (2分)
(2)放热 (1分) < (1分)
(3)>(1分) <(1分)
本题解析:略
本题难度:一般
|