| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《物质的量》练习题(二)
参考答案:A 本题解析:13.5g铝的物质的量为0.5moL,根据2Al+6HCl=2AlCl3+3H2↑,生成氢气1.5mol,则氢气的分子数为1.5NA,A错误;标准状况下,2.24 L CH4所含电子数为NA,B正确;根据n=CV,N=nNA,所以500 mL 1 mol·L-1的K2SO4溶液中含有K+数目为NA,C正确;0.5 mol O2中氧原子数为NA,0.5 mol O3中氧原子数为1.5 NA,氧原子个数总共为2.5NA,D正确。 本题难度:一般 2、选择题 某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子,其物质的量浓度比为Na+:Mg2+:Cl-=3:5:5,若Na+浓度为3mol/L,则SO42-的浓度为 ( ) |
参考答案:C
本题解析:略
本题难度:简单
3、选择题 1 L 0.1 mol·L-1的K2SO4溶液中
A.K+的物质的量为0.1 mol
B.SO42-的物质的量为0.2 mol
C.K+的物质的量浓度为0. 1 mol·L-1
D.SO42-的物质的量浓度为0. 1 mol·L-1
参考答案:D
本题解析:电解质的电离方程式是:K2SO4=2K++SO42-;所以盐的浓度与电离产生的离子的浓度关系符合电离方程式的关系。A.n(K2SO4)=0.1mol,所以K+的物质的量为0.2 mol,错误;B.n(K2SO4)=0.1mol,所以SO42-的物质的量为0.1mol,错误;C.c(K2SO4)=" 0.1" mol/L,所以 K+的物质的量浓度为0. 2 mol/L,错误;D. c(K2SO4)=" 0.1" mol/L,所以SO42-的物质的量浓度为0. 1 mol/L,正确。
考点:考查电解质的浓度、物质的量与电离产生的离子的浓度、物质的量的关系的知识。
本题难度:一般
4、选择题 小明体检的血液体验单中,葡萄糖为5.9×10-3mol/L,表示该体检指标的物理量是(?)
A.溶解度(S)
B.物质的量浓度(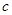 )
)
C.质量分数(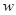 )
)
D.摩尔质量(M)
参考答案:B
本题解析:从表示葡萄糖数据的单位可确定为物质的量浓度。
本题难度:简单
5、选择题 向某二价金属M的M(OH)2的溶液中加入过量的NaHCO3溶液,生成了MCO3沉淀,过滤,洗涤、干燥后将沉淀置于足量的稀盐酸中,充分反应后,在标准状况下收集到V L气体。如要计算金属M的相对原子质量,你认为还必需提供下列哪项数据是?
A.M(OH)2溶液的物质的量浓度
B.与MCO3反应的盐酸的物质的量浓度
C.MCO3的质量
D.题给条件充足,不需要再补充数据
参考答案:C
本题解析:生成的气体是CO2,所以要计算M的相对原子质量,还需要知道MCO3的质量,选项C正确,答案选C。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《烷烃》高频.. | |