|
高考化学知识点总结《物质的量》练习题(四)
2020-08-23 07:49:47
【 大 中 小】
|
1、选择题 欲配制480 mL 0.1 mol/L CuSO4溶液,正确的方法是 ( )
A.称量7.68 g CuSO4溶于水中形成480 mL 溶液
B.称量8.0 g CuSO4溶于500 mL水中
C.称量12.5 g CuSO4· 5H2O溶于水中形成500 mL 溶液
D.称量12.0 g CuSO4· 5H2O溶于480 mL水中
|
参考答案:C
本题解析:实验室需用480mL 0.1mol?L-1 CuSO4溶液,实际上配制的是500mL 0.1mol/L的硫酸铜溶液,需要硫酸铜的质量为8.0g,需要胆矾的质量为12.5g,A.使用500mL的容量瓶无法配制480mL的溶液,A错误;B.需要胆矾的质量为12.5g,且胆矾溶于500mL水中,所得溶液体积不是500mL,B错误;C.12.5 g CuSO4· 5H2O中硫酸铜的物质的量为0.05mol,配成500mL溶液,所得溶液浓度为0.1mol/L,C正确;D.12.0 g胆矾溶于480mL水中,所得溶液的体积不是480mL,所得溶液浓度不是0.1mol/L,D错误。
考点:考查配制一定物质的量浓度的溶液。
本题难度:一般
2、选择题 448mL某气体在标准状况下的质量为1.28g,该气体的摩尔质量约为( )
A.64g
B.64
C.64g·mol-1
D.32g·mol-1
参考答案:C
本题解析:448mL即为0.448L,所以22.4L该气体在标准状况下的质量为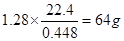 ,所以该气体的摩尔质量约为64g·mol-1?。故本题的答案为C。 ,所以该气体的摩尔质量约为64g·mol-1?。故本题的答案为C。
点评:本题考查了气体摩尔体积的计算,该考点是高考考查的重点和难点,本题要注意气体摩尔体积的单位是g·mol-1。
本题难度:一般
3、实验题 实验室配制500ml 0.1 mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取碳酸钠粉末____________g。
(2)配制时应选用的仪器有500ml容量瓶,托盘天平、烧杯、药匙、___________。
(3)配制时,该实验两次用到玻璃棒,其作用分别是___________、___________。
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
①没有洗涤烧杯和玻璃棒___________。
②如果加水超过了刻度线,取出水使液面恰好到刻度线___________。
③容量瓶没有干燥___________。
参考答案:(1)5.3
(2)玻璃棒、胶头滴管
(3)搅拌;引流
(4)①偏低;②偏低;③无影响
本题解析:
本题难度:一般
4、填空题 一定质量的液态化合物XY2,在标准状况下的一定质量的O2中恰好完全燃烧,反应方程式为:XY2(l)+3O2(g)===XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56 g/L,则:
(1)反应前O2的体积是________________。
(2)化合物XY2的摩尔质量是________________。
(3)若XY2分子中X、Y两元素的质量比是3∶16,则X、Y两元素分别为________和__________(写元素符号)。请写出 Y的离子结构示意图为 。
(4)已知X元素有aX、bX、cX三种原子,Y元素有eY、f Y 两种原子,则它们能够形成 种XY2分子。
参考答案:(1)672mL。 (2)76g/mol。 (3) C和S (写元素符号), 。 (4)9 。 (4)9
本题解析:(1)根据反应的方程式可知,反应前后体积是不变的,所以反应前氧气的体积是672ml。
(2)标准状况下,672ml气体的物质的量是0.672L÷22.4L/mol=0.03mol。即参加反应的氧气是0.03mol,化合物XY2的物质的量是0.01mol。标准状况下的密度是2.56 g/L,则混合气的质量是2.56 g/L×0.672L。根据质量守恒定律可知,0.01×M+0.03×32=2.56 ×0.672,解得M=76,所以化合物XY2的摩尔质量是76g/mol。
(3)设X的相对原子质量是x,则Y的相对原子质量是(76-x)÷2,因此有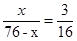 ,解得x=12,所以Y的相对原子质量是32,则X和Y分别是12和32。硫离子的核外电子数是18,其离子的结构示意图是 ,解得x=12,所以Y的相对原子质量是32,则X和Y分别是12和32。硫离子的核外电子数是18,其离子的结构示意图是 。 。
(4)根据数学的排列组合可知,能够形成XY2分子的种数是3×3=9种。
本题难度:一般
5、选择题 将9.2g金属钠投入到足量水中,得ag溶液;9.6g镁投入到足量盐酸中(与水等质量),得到bg溶液,则反应后两溶液质量的关系是 (?)
A.a>b
B.a=b
C.a<b
D.无法判断
参考答案:B
本题解析:将9.2g金属钠与水反应后生成H2的质量为0.4g;9.6g镁投入到足量盐酸中生成H2的质量为0.8g;设足量盐酸(与水等质量)的质量为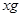 ,则 ,则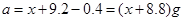 ; ;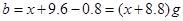 ,因此可得 ,因此可得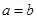 。故答案为B。 。故答案为B。
点评:本题是对物质反应的计算,属于基础题。解题时,对于计算溶液的质量时,应考虑加入的物质(形成溶液),以及“跑出去”的物质(气体),对于形成溶液的,应加;对于生成气体的,应减。
本题难度:一般
|