1、计算题 录像用的高性能磁粉,主要材料之一是由三种元素组成的化学式为CoxFe(3-x)O(3+x)的化合物。已知氧为-2价,钴(Co)和铁可能呈现+2价或+3价,且上述化合物中,每种元素只有一种化合价。则x值为______,铁的化合价______,钴的化合价________。
参考答案:1? +3价? +2价
本题解析:假设Co为+3价,则铁为+2价。则有3x+2(3-x)-2(3+x)=0(化合价代数和为零),解x=0(无Co),不合理。?(据此即可判断应该是Co为+2价,铁为+3价,2x+3(3-x)-2(3+x)=0,解得x=1);当然,如果开始假设? Co为+2价,则铁为+3价,则可直接得出结果。
本题难度:简单
2、填空题 某实验小组用工业废弃固体(主要成分为Cu2S和Fe2O3)制备有关物质,整个流程如下图所示。请回答:
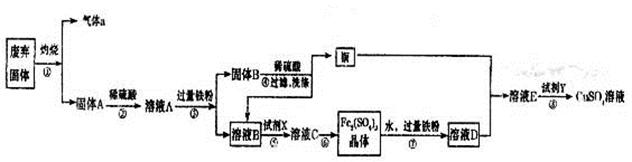
(1)气体a的化学式为?。
(2)溶液B加入硫酸酸化后再加入适宜氧化剂X得到溶液C,写出该反应的离子方程式?。
(3)制备硫酸铜溶液。常温下,O2、铜粉和稀硫酸三者在一起,几乎不反应,当加入溶液D后,随即生成硫酸铜。经理阅资料发现FeSO4对铜的氧化起催化作用。
A.第一步反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,则第二步反应的郭子方程式为?。
B.⑦操作中,配制Fe2(SO4)3溶液时应注意?。
(4)操作⑧的目的是得到较纯的硫酸铜溶液。加入适宜试剂Y调节pH至铁元素全部沉淀(离子浓度小于10-5mol/L),然后再过滤,浓缩、结晶等,则pH至少调节为_____。
已知:Ksp[Cu(OH)2]≈1×10-22,Ksp[Fe(OH)2] ≈1×10-16,Ksp[Fe(OH)3] ≈1×10-38
(5)科学家发现纳米级的Cu2O在太阳光照射下可以催化分解水。
A.一定温度下,在2L密闭容器中加入纳米级Cu2O,通入2mol水蒸气,发生如下反应:
2H2O(g)=2H2(g)+O2(g)?△H=+484kJ/mol
20min末测得n(O2)=0.16mol,则这段时间的反应速率υ(H2)=_________;该温度下,此反应的平衡常数表达式K=___________________。
B.已知:2Cu2O(s)+O2(g)=4CuO(s)?△H=-292kJ/mol
2C(s)+O2(g)=2CO(g)?△H=-221kJ/mol
请写出炭粉还原CuO(s)制备Cu2O(s)的热化学方程式_________________。
参考答案:(除去注明外,每空2分,共14分)(1)SO2(1分)
(2)2Fe2++H2O2+2H+=2Fe3++2H2O或4Fe2++O2+4H+=4Fe3++2H2O
(3)2Fe3++Cu=2Fe2++Cu2+;向配制溶液中加入少量的硫酸防止水解或将Fe2(SO4)3溶解在稀硫酸中,再加水稀释 (4)3 (5)0.008mol/(L·min)(单位占1分);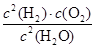 (1分);
(1分);
2CuO(s)+C(s)=CO(g)+Cu2O(s)?△H=+35.5 kJ/mol
本题解析:(1)Cu2S灼烧生成SO2和铜,反应的化学方程式是Cu2S+O2 2Cu+SO2↑,因此气体a是SO2。
2Cu+SO2↑,因此气体a是SO2。
(2)固体A是氧化铁和铜的混合物,加入稀硫酸固体溶解生成硫酸铁,进而硫酸铁又溶解铜,所以溶液A是硫酸铁、硫酸亚铁、硫酸铜以及硫酸的混合液。加入过量的铁粉后生成硫酸亚铁和铜,所以固体B是铜和铁的混合物,溶液B是硫酸亚铁。要得到硫酸铁晶体,则需要将硫酸亚铁氧化生成硫酸铁,因此氧化剂X可以是双氧水或氧气,有关的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O或4Fe2++O2+4H+=4Fe3++2H2O。
(3)由于铁离子具有氧化性,能把铜氧化生成铜离子,而铁离子又被还原生成亚铁离子,因此第二步反应的离子方程式是2Fe3++Cu=2Fe2++Cu2+;由于铁离子易水解生成氢氧化铁,所以配制硫酸铁溶液时,要防止铁离子水解,因此正确的操作应该是向配制溶液中加入少量的硫酸防止水解或将Fe2(SO4)3溶解在稀硫酸中,再加水稀释。
(4)溶液E是硫酸铜和硫酸亚铁的混合液,根据溶度积常数可知,要得到硫酸铜溶液,需要除去亚铁离子。由于氢氧化亚铁的溶度积常数大于氢氧化铜的,但氢氧化铁的溶度积常数小于氢氧化铜的,所以应该加入氧化剂将亚铁离子氧化成铁离子。根据氢氧化铁的溶度积常数可知,要调节pH至铁元素全部沉淀(离子浓度小于10-5mol/L),溶液中的OH-应该为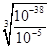 =10-11mol/L,所以pH至少调节为3。
=10-11mol/L,所以pH至少调节为3。
(5)20min末测得n(O2)=0.16mol,则根据方程式可知,生成氢气是0.16mol×2=0.32mol,其浓度是0.32mol÷2L=0.16mol/L,因此氢气的反应速率υ(H2)=0.16mol/L÷20min=0.008mol/(L·min)。化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此根据方程式可知该温度下,此反应的平衡常数表达式K=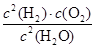 ;根据反应①:2Cu2O(s)+O2(g)=4CuO(s)?△H=-292kJ/mol和反应②:2C(s)+O2(g)=2CO(g)?△H=-221kJ/mol并依据盖斯定律可知,(②-①)÷2即得到反应2CuO(s)+C(s)=CO(g)+Cu2O(s),所以该反应的反应热△H=(-221kJ/mol+292kJ/mol)÷2=+35.5 kJ/mol。
;根据反应①:2Cu2O(s)+O2(g)=4CuO(s)?△H=-292kJ/mol和反应②:2C(s)+O2(g)=2CO(g)?△H=-221kJ/mol并依据盖斯定律可知,(②-①)÷2即得到反应2CuO(s)+C(s)=CO(g)+Cu2O(s),所以该反应的反应热△H=(-221kJ/mol+292kJ/mol)÷2=+35.5 kJ/mol。
本题难度:困难
3、实验题 氯化铜、氯化亚铜是重要的化工原料,广泛地用作有机合成催化剂。
I.实验室中以粗铜(含杂质Fe)为原料制备铜的氯化物。现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹、酒精灯已省略)。按要求回答下列问题:
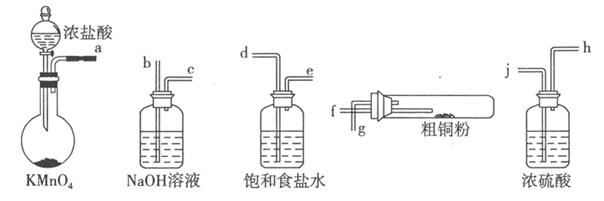
(1)按气流方向连接各仪器接口顺序是:a ??、?
??、? ??、?
??、? ??、 ?
??、 ? ??
??
(2)写出加热时硬质试管中发生化学反应的方程式是?。
(3)反应后,盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化腐蚀过程中正极反应式是?.
II.将上述实验制得的固体产物按如下流程操作,试回答下列问题:
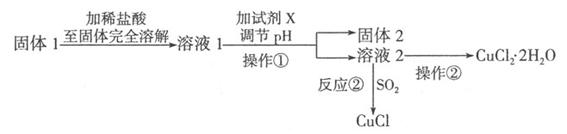
(1)检验溶液2中是否含有杂质离子的试剂是?;
(2)某同学用实验制得的CuCl2·2H2O晶体配制0.1 mol·L-1的CuCl2溶液,在称量出CuCl2·2H2O晶体后,溶解该晶体的具体操作为 ??
(3)溶液l可加试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)?
a.NaOH? b.NH3·H2O? C.CuO? d.CuSO4? e.Cu2(OH)2CO3
(4)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式:? .
参考答案:Ⅰ:(1)d e j h f g b(3分)(2)Cu+Cl2 CuCl2,(2分)2Fe+3Cl2
CuCl2,(2分)2Fe+3Cl2 2FeCl3(2分)(3)ClO-+2e-+H2O=Cl-+2OH-(2分)(2分)Ⅱ:(1)KSCN溶液;(2分)(2)将称量的晶体置于烧杯中,加入适量的稀盐酸和蒸馏水,用玻璃棒搅拌(3分)(3)c、e(2分)(4)2Cu2++2Cl-+SO2+2H2O
2FeCl3(2分)(3)ClO-+2e-+H2O=Cl-+2OH-(2分)(2分)Ⅱ:(1)KSCN溶液;(2分)(2)将称量的晶体置于烧杯中,加入适量的稀盐酸和蒸馏水,用玻璃棒搅拌(3分)(3)c、e(2分)(4)2Cu2++2Cl-+SO2+2H2O 2CuCl↓+4H++SO42-(3分)
2CuCl↓+4H++SO42-(3分)
本题解析:
试题解析:(1)制得的氯气先通过饱和食盐水除去氯化氢气体,再通过浓硫酸除水,然后再通入粗铜中,最后进行尾气处理。(2)在硬质试管中铜和铁都与氯气反应;(3)根据题目信息可知,电池反应应该为铁和次氯酸钠反应,故正极为次氯酸根得电子生成氯离子。Ⅱ:(1)固体1中加入盐酸反应后溶液中含有铁离子、铜离子和亚铁离子,加入试剂目的是把亚铁离子氧化成铁离子,调节pH使铁离子水解生成沉淀而除去,故溶液2中的杂质离子为铁离子,加入KSCN溶液检验;(2)溶解氯化铜时要加入盐酸抑制铜离子的水解;(3)加入的试剂X能与氢离子反应调节pH而又不能引入新的杂质,故选择c和e;(4)根据已知信息铜离子和二氧化硫反应生成CuCl,铜离子发生还原反应,二氧化硫被氧化成硫酸根离子,再依据离子方程式中的电荷守恒和原子守恒得离子方程式。
本题难度:困难
4、选择题 下列物质不能由铜单质与其它物质发生化合反应得到的是(?)
A.CuO
B.CuS
C.Cu2S
D.CuCl2
参考答案:B
本题解析:略
本题难度:简单
5、填空题 (12分)利用染化厂的废料铁泥(主要成分是Fe2O3、FeO和铁)制备可用于隐形飞机涂层的纳米四氧化三铁的生产流程为:
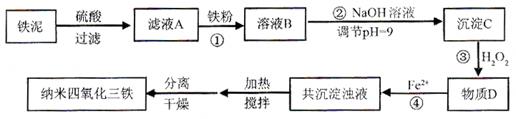
请回答:
(1)过程①主要反应的离子方程式为?。
(2)已知氢氧化亚铁的Ksp=4.87×10-17,氢氧化铁的Ksp=2.6×10-39。
当溶液中某离子浓度不高于1×10-5 mol·L-1时,可以认为该离子已经完全沉淀。通过计算所得数据说明过程②调节pH=9的原因是?。
(3)物质D的主要产物中铁、氢、氧三种元素的质量比为56∶1∶32,则过程③主要反应的化学方程式为?。
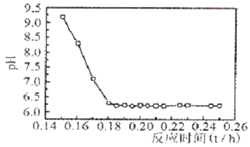
(4)已知Fe2+在弱碱性溶液中还原性较强,图11是研究过程④的实验所得,则该反应所需的时间控制在?小时左右,较为适宜。
(5)某工厂处理废铁泥(测得铁元素含量为16.8 %)的能力为10吨/小时,生产纳米四氧化三铁的产量为4.64吨/小时。如不考虑过程④以后生产中Fe2+的氧化,则该工厂每小时消耗铁粉的质量为?千克。
参考答案:(1)2Fe3+ + Fe = 3Fe2+?(2分)?(2)当pH=9时,c(Fe2+)=4.87×10-7mol·L—1 (2分)
(3)2Fe(OH)2 +H2O2=2FeO(OH)+2H2O(物质D写成Fe(OH)O或FeHO2、FeO2H均可以)(2分)?(4)0.16(2分)?(5)560(4分)
本题解析:(1)滤液A中含有铁离子,所以方程式为2Fe3+ + Fe = 3Fe2+。
(2)根据氢氧化亚铁的溶度积常数可知,当pH=9时,c(Fe2+)=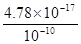 4.87×10-7mol·L—1,此时已经完全沉淀。
4.87×10-7mol·L—1,此时已经完全沉淀。
(3)铁、氢、氧三种元素的质量比为56∶1∶32,则原子个数之比时1︰1︰2,即化学式为FeO(OH),所以反应式是2Fe(OH)2 +H2O2=2FeO(OH)+2H2O。
(4)根据图11可知,当溶液显弱碱性时,对应的时间大约是0.16h。
(5)4.64吨四氧化三铁中铁的质量是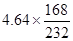 =3.36吨,其中相当于氧化铁的质量是2.24吨,另外的铁来自于亚铁离子。10吨铁泥中铁的质量是16.8 %×10=1.68吨,所以需要铁粉的质量是2.24吨-1.68吨=0.56吨。
=3.36吨,其中相当于氧化铁的质量是2.24吨,另外的铁来自于亚铁离子。10吨铁泥中铁的质量是16.8 %×10=1.68吨,所以需要铁粉的质量是2.24吨-1.68吨=0.56吨。
本题难度:一般