1、选择题 某化工厂排放的酸性废液里含有游离的氯。要除去游离氯并中和其酸性,正确方案是?
A.先加适量的Na2SO3,再加适量的NaOH
B.先加适量的NaOH,再加适量的Na2SO3
C.先加过量的Na2SO3,再加适量的NaOH
D.先加过量的NaOH,再加适量的HCl
参考答案:A
本题解析:实际的化工处理过程中,要通过取样化验达到控制原料的投量,切勿盲目过量投入达到目的,否则是浪费。本题再明白其原理:
Na2SO3+Cl2+H2O==Na2SO4+2HCl
H++OH-==H2O
选A。
本题难度:一般
2、填空题 已知某待测液由Ag+、Fe2+、Al3+、K+、Ba2+、NH4+、NO3-、SO42-中的若干种离子组成,进行如下实验:

第一步:加入过量的稀盐酸,无沉淀生成。
第二步:继续加入过量的稀硫酸,有白色沉淀生成。
第三步:过滤,取少量滤液,滴入NaOH溶液至溶液呈碱性,
在此过程中溶液沉淀量的变化如右图所示,加热该溶液,
可产生使湿润的红色石蕊试纸变蓝色的气体。
根据以上实验现象回答下列问题:
(1)该待测液中一定含有?离子,一定没有?离子,可能有?离子。
(2)某同学采用测pH的方法来判断滴入NaOH溶液后是否使溶液呈碱性,该实验操作是?。
(3)第三步中产生使湿润红色石蕊试纸变蓝色的气体的离子方程式为?,该步骤中预
期会出现另外一个特殊的实验现象,该现象对应的化学方程式为?。
参考答案:(1)Fe2+、Al3+、Ba2+、NH4+、NO3-? SO42-、Ag+? K+
(2)取一片pH试纸置于表面皿上,用洁净的玻璃棒蘸取待测液,点在pH试纸的中部,半分钟后与标准比色卡对照,判断溶液是否呈碱性。
(3)NH4++OH-  ?NH3↑+H2O? 4Fe(OH)2+O2+2H2O=4Fe(OH)3
?NH3↑+H2O? 4Fe(OH)2+O2+2H2O=4Fe(OH)3
本题解析:(1)加入HCl无沉淀生成说明不含有Ag+。继续加入过量的稀硫酸,有白色沉淀生成说明含有Ba2+离子。发生的沉淀反应的方程式为Ba2++ SO42-=BaSO4↓。向过滤后的滤液中滴入NaOH溶液至溶液呈碱性首先产生沉淀。当沉淀达到最大值后再滴加。沉淀量不变,后沉淀又减少一部分。说明还含有Fe2+、Al3+、NH4+。根据溶液呈电中性可知溶液中还应该含有阴离子。由于Ba2+和 SO42-不能共存,含有Ba2+离子,SO42-不能存在。故一定还含有NO3-离子。故该待测液中一定含有Fe2+、Al3+、Ba2+、NH4+、NO3-;一定不含有SO42-、Ag+; K+可能有也可能没有。(2)判断溶液是否呈碱性,该实验操作是取一片pH试纸置于表面皿上,用洁净的玻璃棒蘸取待测液,点在pH试纸的中部,半分钟后与标准比色卡对照,判断溶液是否呈碱性。(3)产生使湿润红色石蕊试纸变蓝色的气体的离子方程式为NH4++OH-  ?NH3↑+H2O .?该步骤中可能会出现另外一个特殊的实验现象就是Fe(OH)2不稳定,容易被空气中的氧气氧化为Fe(OH)3,会看到首先产生白色沉淀,产生沉淀迅速变为灰绿色,最后变为红褐色。该现象对应的化学方程式为4Fe(OH)2 +O2+ 2H2O=4Fe(OH)3。
?NH3↑+H2O .?该步骤中可能会出现另外一个特殊的实验现象就是Fe(OH)2不稳定,容易被空气中的氧气氧化为Fe(OH)3,会看到首先产生白色沉淀,产生沉淀迅速变为灰绿色,最后变为红褐色。该现象对应的化学方程式为4Fe(OH)2 +O2+ 2H2O=4Fe(OH)3。
本题难度:一般
3、实验题 制备无水乙醇的实验原理:由于乙醇95.6%、水4.4%组成一种混合物,常压下,它有一定的沸点(78.17 ℃),这个沸点低于水的(100 ℃)也低于纯乙醇的沸点(78.3 ℃),所以只靠简单蒸馏酒精,所得乙醇纯度最高只能达到95.6%,尚含有4.4%的水。如果要得到含量较高的乙醇,在实验室中常用的简便方法是加入生石灰回流(回流是在一个可以加热的反应容器中,把液体加热使受热转化生成的蒸气通过冷凝器冷凝又回流到原容器的操作。见图甲),回流之后再蒸馏,可得99.5%的乙醇,通常称为无水乙醇。如果要得到纯度更高的绝对乙醇(含乙醇99.95%),则还要用金属钠进行处理,借以除去最后微量的水分。
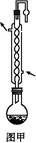
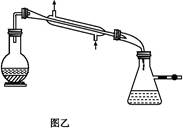
实验步骤:取干燥的250 mL圆底烧瓶一个,加入95%乙醇100 mL和小块生石灰30 g,振摇后用橡皮塞塞紧,放置过夜。在烧瓶口装上回流冷凝管,管口接一支氯化钙干燥管(装置见图甲),在水浴上加热回流1至2小时,稍冷,取下冷凝管,改装成蒸馏装置(如图乙),再放在热水浴中蒸馏,把最初蒸出的5 mL馏出液另外回收,然后用烘干的吸滤瓶作为接收器,其侧管接一支氯化钙干燥管,使其与大气相通,蒸至无液滴出来为止,量取所得乙醇的体积,计算回收率。请回答:
(1)为什么回收或蒸馏时都要装上氯化钙干燥管?
? 。
(2)为了防止回流系统外部湿气侵入,有人用塞子把冷凝管上端塞紧,这样做是否可行,为什么?? 。
(3)无水氯化钙常用作吸水剂,如用无水氯化钙代替氧化钙投入酒精中,放置过夜,然后过滤。用此方法进行本实验制取乙醇是否可行,为什么?
? 。
(4)一般用干燥剂干燥有机物时,在蒸馏前应先过滤,但用氧化钙制备无水乙醇时,为什么可不过滤,留在瓶中一起蒸馏?
? 。
(5)为什么最初蒸出的5 mL馏出液另外收集,它的纯度是否已达99.5%?
? 。
参考答案:(1)本实验要求无水操作,要求严密,防止大气中的湿气进入本体系
(2)不可行。如果塞紧,回流系统就成了封闭系统。封闭系统受热后,将会发生过热、冲料、爆炸、着火(酒精可燃)等意外事故
(3)不可行。氯化钙可以用作吸水剂,但它受热后又可使结合的水再释出,达不到干燥的目的,且氯化钙也可以吸附乙醇
(4)氧化钙跟水发生反应生成的氢氧化钙是不挥发的,受热也不分解,所以不影响蒸馏纯乙醇
(5)冷凝管内管管壁等仪器的表面尚附有湿气,因此最初的几毫升蒸馏液可能含有的水分相对多一些,纯度达不到99.5%,所以另外收集,以免影响所收集乙醇的纯度(每空3分)
本题解析:(1)整个实验过程需要避开水,因而要防止大气中的水蒸气进入装置。(2)如果用塞子把冷凝管上端塞紧,则会导致系统成为密闭系统,会导致实验事故。(3)无水氯化钙吸水后生成的产物会在受热时失水,达不到目的。(4)氧化钙与水反应生成的Ca(OH)2不挥发,而且受热不分解,不影响蒸馏乙醇。(5)需要考虑仪器内壁附着的水滴,使得所得乙醇的浓度降低。
本题难度:一般
4、选择题
A.烧碱溶液
B.盐酸
C.食盐溶液
D.氯化钡溶液
参考答案:B
本题解析:从沉淀角度考虑,都是白色沉淀,没有区分度;若从产生气体的角度考虑,现象不一样,分别产生H2S、SO2、CO2气体。
本题难度:简单
5、简答题 除杂(括号内为杂质)
| 序号 | 物质 | 除杂试剂
(1)
CO2(HCl)
(2)
Fe2O3(Al2O3)
(3)
NaCl溶液(MgCl2)
(4)
NO气体(NO2)
参考答案:(1)CO2中混入HCl,可加入NaHCO3除去,反应的离子方程式为HCO3-+H+=CO2↑+H2O,故答案为:饱和碳酸氢钠溶液;
(2)Fe2O3不与氢氧化钠溶液反应,而Al2O3能和氢氧化钠溶液反应,故答案为:过量的氢氧化钠溶液;
(3)氯化镁能与氢氧化钠反应生成氢氧化镁沉淀和氯化钠,故答案为:适量的氢氧化钠溶液;
(4)将混和气体通入到盛有水的装置中,化学方程式是:3NO2+H2O=NO+2HNO3,故答案为:水.
本题解析:
本题难度:一般
|