1、计算题 由铜片、锌片和100mL稀硫酸溶液组成的原电池中,当铜片上产生2.24L(标态)气体时,硫酸恰好作用完,试计算:
⑴锌片质量减轻了 克 ⑵原稀硫酸溶液的物质的量浓度是
2、计算题 合成氨然后再生产尿素是最重要的化工生产。
I.在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:
3H2(g) + N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
| 容器 | 甲
| 乙
| 丙
|
反应物投入量
| 3 mol H2、2 mol N2
| 6 mol H2、4mol N2
| 2 mol NH3
|
达到平衡的时间/min
|
| 5
| 8
|
平衡时N2的浓度/mol·L-1
| c1
| 1.5
|
|
NH3的体积分数
| ω1
|
| ω3
|
混合气体密度/g·L-1
| ρ1
| ρ2
|
|
(1)容器乙中反应从开始到达平衡的反应速率为v(H2)=___________。
(2)在该温度下甲容器中反应的平衡常数K= (用含c1的代数式表示)。
(3)分析上表数据,下列关系正确的是________(填序号):
a.2c1 > 1.5 b.2ρ1 = ρ2 c.ω3 = ω1
II.工业上用氨气合成尿素(H2NCONH2)的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4 (l) (氨基甲酸铵) △H1
H2NCOONH4 (l) (氨基甲酸铵) △H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2
(4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如左下图I所示:
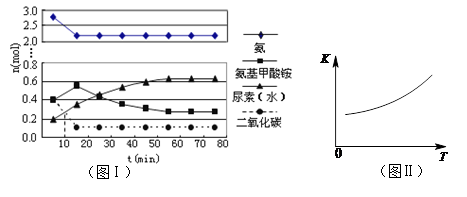
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
②第二步反应的平衡常数K随温度T的变化如右上图II所示,则△H2 0;③若第一步反应升温时氨气浓度增大,请在图II中画出第一步反应K1随温度T变化曲线,并作出必要的标注。
(5)氨和尿素溶液都可以吸收硝工业尾气中的NO、NO2,将其转化为N2。
①尿素与NO、NO2三者等物质的量反应为:CO(NH2)2+NO+NO2 =CO2+2N2+2H2O
该反应中的氧化剂为 (写化学式)。
②已知:N2(g)+O2(g)= 2NO(g) △H ="a" kJ·mol-1
N2(g)+3H2(g)= 2NH3(g) △H2="bkJ·" kJ·mol-1
2H2(g)+O2(g)= 2H2O(g) △H=" c" kJ·mol-1
则4NH3(g) +4NO(g) +O2(g)= 4N2(g)+6H2O(g) △H= 。
③尿素燃料电池结构如下图所示。其工作时负极电极反应式可表示为 。

3、选择题 化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
[? ]
A.用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl-=Cl2↑+2e-
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,正极反应式为:Cu =Cu2+ +2e-
D.钢铁发生电化学腐蚀的正极反应式:Fe=Fe2++2e-
4、填空题 (10分)组成一种原电池如图所示。试回答下列问题(灯泡功率合适):
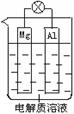
(1)电解质溶液为稀H2SO4时,灯泡______(填“亮”做①题,填“不亮”做②题) 。
。
①若灯泡亮,则Mg电极上发生的反应为:____________________;
Al电极上发生的反应为:___________________________________。
②若灯泡不亮,其理由为:__________________________________。
(2)电解质溶液为NaOH溶液时,灯泡_____?(填“亮”做①题,填“不亮”做②题)。
①若灯泡亮,则Al电极上发生的反应为:_____________________________。
②若灯泡不亮,其理由为:__________________________________________。
5、填空题 (I)将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置。试回答下列问题:
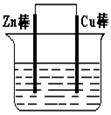
(1)若电解质溶液为稀硫酸,则Zn棒为原电池的?极,可观察到Cu棒上产生现象是?,试用电极反应式表示该现象:?。
(2)若电解质为硫酸铜溶液,则Cu棒上发生?反应(填“氧化”“还原”),Zn棒上发生反应的电极反应式为:?。
(3)若在上述两个过程中,Zn棒减少的质量相等,则Cu棒上(1)和(2)所析出物质的质量之比为:?。
(II)A、B、C三个烧杯中分别盛有500mL相同物质的量浓度的稀硫酸
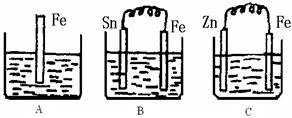
(1)写出A中离子反应方程式:?
(2)一段时间后,B中Sn极附近溶液的pH?(填“增大”、“减小”、“不变”)。
(3)一段时间后,C中产生了5.6L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度为?
(4)反应完成后三个烧杯中液体质量大小顺序为:A?B?C (用<、=、>连接)。