1、填空题 煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g) H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
试回答下列问题
⑴上述正向反应是???反应(填“放热”或“吸热”)。
⑵在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有???(选填A、B、C、D、E)。
?
| n(CO)
| n(H2O)
| n(H2)
| n(CO2)
|
A
| 1
| 5
| 2
| 3
|
B
| 2
| 2
| 1
| 1
|
C
| 3
| 3
| 0
| 0
|
D
| 0.5
| 2
| 1
| 1
|
E
| 3
| 1
| 2
| 1
|
⑶已知在一定温度下:
C(s)+CO2(g) 2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s)+H2O(g) CO(g)+H2(g)?平衡常数K1;
CO(g)+H2(g)?平衡常数K1;
CO(g)+H2O(g) H2(g)+CO2(g)平衡常数K2;
H2(g)+CO2(g)平衡常数K2;
则K、K1、K2之间的关系是K=???。
⑷若在500℃时进行,设起始时CO和H2O的起始浓度均为0.010mol/L,在该条件下,CO的平衡转化率为:???。
⑸若反应在800℃进行,设起始时CO(g)和H2O(g)共为1mol,水蒸气的体积分数为x;平衡时CO转化率为y,则y随x变化的函数关系式为:y=???。
参考答案:⑴放热?⑵BCD?⑶K1/K2?⑷75%?⑸X
本题解析:(1)根据表中数据可知,随着温度的升高,平衡常数减小,说明升高温度平衡向逆反应方向移动,所以正方应是放热反应。
(2)由于反应前后体积不变,所以设容器的容积是1L,则ABCD中 的比值分别是
的比值分别是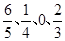 ,所以其中向正反应方向移动的有BCD。
,所以其中向正反应方向移动的有BCD。
(3)根据盖斯定律可知,①-②即得到C(s)+CO2(g) 2CO(g),所以该反应的平衡常数K=
2CO(g),所以该反应的平衡常数K=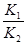 。
。
(4)? CO(g)+H2O(g) H2(g)+CO2(g)
H2(g)+CO2(g)
起始浓度(mol/L) 0.010? 0.010? 0? 0
转化浓度(mol/L)? x? x? x? x
平衡浓度(mol/L)0.010-x? 0.010-x? x? x
则根据平衡常数表达式可知
解得x=0.0075mol/L
则在该条件下,CO的平衡转化率为75%
(5)? CO(g)+H2O(g) H2(g)+ CO2(g)
H2(g)+ CO2(g)
起始浓度(mol/L) 1-x? x? 0? 0
转化浓度(mol/L)(1-x)y?(1-x)y?(1-x)y (1-x)y
平衡浓度(mol/L)1-x-y+xy? x -y+xy?(1-x)y (1-x)y
则根据平衡常数表达式可知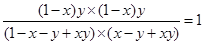
解得x=y
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力和抽象思维能力,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:一般
2、选择题 在0.lmol/L的HA溶液中存在如下电离平衡: HA A-+H+,对于该溶液,下列叙述正确的是(? )
A-+H+,对于该溶液,下列叙述正确的是(? )
A.滴加少量0.lmol/L HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减少
B.加水,溶液中所有离子浓度均减小
C.加入少量NaA固体,平衡向逆反应方向移动, 溶液中c(OH-)增大
D.加入少量NaOH固体,平衡向正反应方向移动, 溶液中c(H+)增大
参考答案:C
本题解析:略
本题难度:简单
3、计算题 煤中含有硫,燃烧时会产生有害的SO2,用生石灰可以消除SO2,减少污染,其反应为CaO(s)+SO2(s) == CaSO3(s) 298K、1.01×105Pa时,此反应的△H==-402.0 kJ·mol-1,△S==-345.7 J·mol-1·K-1,在室温下自发进行。则保持此反应自发进行的最高炉温是多少(焓变△H及熵变△S受温度的影响可忽略)?
参考答案:1162.9℃
本题解析:
本题难度:一般
4、选择题 下列叙述正确的是 (? )
A.反应NH3(g)+HCl(g)=NH4Cl(s)△H<0,在任何条件下均能自发进行
B.铅蓄电池在放电过程中,负极质量减小,正极质量增加
C.温度一定时,水的离子积常数Kw不随外加酸(碱)浓度的改变而改变
D.由于Ksp(BaSO4)小于Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀
参考答案:C
本题解析:A中是熵值减小的反应,根据△G=△H-T·△S可知,反应在低温下自发进行,不正确。B不正确,铅蓄电池在放电过程中,负极质量和极质量均是增加的。能否生成BaCO3沉淀,关键是溶液中c(Ba2+)·c(CO32-)>Ksp(BaCO3),所以D是不正确。因此正确的答案是C。
本题难度:一般
5、填空题 按要求完成下列问题:
(1)在25℃、101kPa下,1g甲醇(液体,分子式为CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为____________________;将该反应设计成碱性燃料电池,写出该电池的负极电极反应方程式 。
(2)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=-247.4 kJ·mol-1
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
(3)已知白磷、红磷燃烧的热化学方程式分别为
P4(s,白磷)+ 5O2=P4O10(s);ΔH=
参考答案:
本题解析:
本题难度:困难