1、填空题 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义
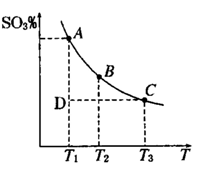
(1)硫酸生产中,SO2催化氧化生成SO3; 2SO2(g)+O2(g) 2SO3(g),混合体系中SO3 的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题,
2SO3(g),混合体系中SO3 的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题,
①2SO2(g)+O2(g) 2SO3(g)的△H 0
2SO3(g)的△H 0
(填“>”或“<”):若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不”)
②若温度为T1、T2,反应的平衡常数分别为K1,K2,则K1 K2;反应进行到状态D时, 
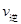 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农 业生产、生活中有着重要作用,
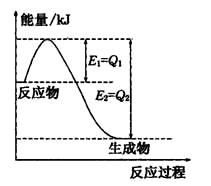
①如图是一定的温度和压强下N2和H2反应生成lmolNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式:
(△H的数值用含字母Q1、Q2的代数式表示)
②氨气溶于水得到氨水,在25℃下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合,反应后溶液显中性,则c(NH4+) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示出该混合溶液中氨水的电离平衡常数 .
(3)海水中含有大量的元素,常量元素如氯,微量元素如碘,其在海水中均以化合态存在,在25℃下,向0.1L0.002mol·L-l的NaCl溶液中逐滴加入适量的0.1L0.002mol·L-l硝酸银溶液,有白色沉淀生成,从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中继续加入0.1L0.002mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知:25℃时KSP(AgCl)=1.6×l0-10 KSP(AgI)=1.5×l0-16)
参考答案:(1)①< 向左 (2分)
②> > (2分)
(2)①N2(g)+3H2(g)  2NH3(g)△H=2(Q1-Q2)KJ/mol (3分)
2NH3(g)△H=2(Q1-Q2)KJ/mol (3分)
②= (1分)  (1分)
(1分)
(3)C(Ag+)·C(Cl-)>KSP(AgCl) (1分) 白色沉淀变成黄色(1分)
AgCl(s)+I-(aq)=AgI(s)+Cl-(ag) (2分)
本题解析:(1))①由图可知,温度越高,混合体系中SO3的百分含量越小,说明升高温度平衡向逆反应进行,即向左移动,升高温度向吸热反应方向移动,即该反应正反应为放热反应;恒温、恒压条件下向上述平衡体系中通入氦气,体积应增大,反应混合物各组分的浓度降低,等效为降低压强,压强降低平衡向体积增大方向移动,即向左移动.
②温度升高,平衡向吸热方向移动,即向逆反应移动,K值减小,K1>K2,D状态未达平衡,混合体系中SO3的百分含量小于平衡时的,反应向正反应进行,所以V正>V逆,
(2)①由图可知,N2和H2反应生成1molNH3放出的热量为(Q1-Q2)kJ,该反应的热化学反应方程式为N2(g)+3H2(g)  2NH3(g) △H=2(Q1-Q2)KJ/mol ,
2NH3(g) △H=2(Q1-Q2)KJ/mol ,
②amol·L-1氨水溶液和bmol·L-1盐酸溶液等体积混合后反应生成氯化铵溶液,溶液中存在电荷守恒,c(NH4+)+c(H+)=c(Cl-)+c(OH-),溶液呈中性c(H+)=c(OH-),所以c(NH4+)=c(Cl
本题难度:困难
2、选择题 在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:Ca(OH)2(s)  ?Ca(OH)2(aq)
?Ca(OH)2(aq)  ?Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是(? )
?Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是(? )
A.n(Ca2+)增大
B.c(Ca2+)不变
C.n(OH-)增大
D.c(OH-)减小
参考答案:B
本题解析:因为温度不变,则Ca(OH)2的溶解度不变,故c(Ca2+)不变。故选B。
点评:本题考查的是溶解平衡的应用和溶解度的相关知识,题目难度不大,注意对基础知识的学习、掌握及应用。
本题难度:一般
3、选择题 在一混合溶液中含有KCl、KBr、K2CrO4,其浓度均为0.01 mol·L-1,向溶液中逐滴加入0.01 mol·L-1AgNO3溶液时,最先和最后沉淀的物质是(?)
(AgCl、 AgBr、 Ag2CrO4的Ksp分别为1.77×10-10、5.35×10-13、1.12×10-12)
A.AgBr、AgCl
B.Ag2CrO4、AgCl
C.AgBr、Ag2CrO4
D.同时沉淀
参考答案:C
本题解析:略
本题难度:简单
4、选择题 将AgCl分别加入盛有:①5 mL水;② 6 mL 0.5 mol/L NaCl溶液;③10 mL 0.2 mol/L CaCl2溶液;④50 mL 0.1 mol/L 盐酸的烧杯中,均有固体剩余,各溶液中c(Ag+)从大到小的顺序排列正确的是
[? ]
A.④③②①
B.②③④①
C.①④③②
D.①③②④
参考答案:C
本题解析:
本题难度:一般
5、选择题 把Ca(OH)2固体放入一定量的蒸馏水中,有?Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),一定温度下达到平衡:当向悬浊液中加少量 生石灰后,若温度保持不变,下列判断正确的是( )
A.溶液中Ca2+数目增多
B.溶液中c(Ca2+)增大
C.溶液pH值不变
D.溶液pH值增大
参考答案:向悬浊液中加少量生石灰,发生:CaO+H2O=Ca(OH)2,
A.加入CaO,消耗水,由于原溶液已达到饱和,则平衡向逆反应方向移动,溶液中Ca2+数目减少,故A错误;
B.反应后仍为饱和溶液,c(Ca2+)不变,故B错误;
C.反应后仍为饱和溶液,c(OH-)不变,溶液pH不变,故C正确;
D.反应后仍为饱和溶液,c(OH-)不变,溶液pH不变,故D错误.
故选C.
本题解析:
本题难度:一般