1、选择题 在NO2与H2O的反应中,发生还原反应和发生氧化反应的物质的质量比为(?)。
A.3:1
B.1:3
C.1:2
D.2:1
参考答案:C
本题解析:3 NO2 +H2O=2HNO3 +NO,NO2与水发生岐化反应,3个N原子中有两个N自+4价升高至+5价,另一下降低至+2价,故答案为C
本题难度:一般
2、选择题 下列物质中,属于电解质的是
A.铜
B.酒精
C.蔗糖
D.食盐晶体
参考答案:D
本题解析:铜是单质,不是电解质,也不是非电解质。酒精和蔗糖是非电解质,氯化钠是电解质,答案选D。
考点:考查电解质的判断
点评:溶于水或熔融状态下能够自身电离出离子的化合物是电解质,再上述条件下,都不能电离出离子的化合物是非电解质,据此可以判断电解质和非电解质。
本题难度:一般
3、填空题 (15分)铜及其化合物与生产、生活关系密切。
(1)用新制Cu(OH)2与葡萄糖反应制备Cu2O,该反应中葡萄糖是 (填“氧化剂”或“还原剂”)
(2)用H2O2稀硫酸共同浸泡废印刷电路板可制备CuSO4若将该反应设计成原电池,
正极的电极反应式为
(3)用NH4NO3氧化海绵铜(含Cu和CuO)生产CuCl的部分流程如下:
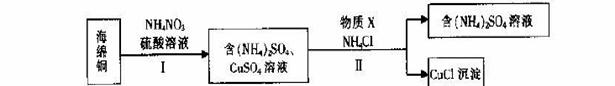
①步骤I中,反应温度不宜过高的原因是 。
②步骤I中,0.5 mol NH4NO3参加反应有4mol电子转移,铜参与反应的离子方程式为 。
③步骤II中,物质X可选用的物质是 。(填序号)。
a.Cu b.C12 c.H2O2 d.(NH4)2SO3
④步骤II中物质X需要过量的原因,其一是加快反应速率,其二是 _。
⑤步骤II中当NH4 Cl加到一定的量时,生成CuCl 会部分溶解生成CuCl2-在一定温度下建立两个平衡:
Cu Cl(s) 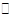 Cu+(a q) + Cl-(a q) Ksp=1.4x10-6
Cu+(a q) + Cl-(a q) Ksp=1.4x10-6
Cu Cl(s) + Cl一(a q)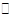 CuCl2(a q) K=0.35
CuCl2(a q) K=0.35
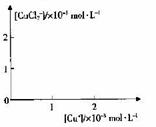
分析[Cu+]、[CuCl2-]和Ksp,K的数学关系,在图中画出「Cu+]、[CuCl2]-的关系曲线(要求至少标出坐标点)
参考答案:(1)还原剂 (2)H2O2+2e-+2H+=2H2O
(3)①防止产生氮氧化物造成污染
②4Cu+NO3-+10H+=4Cu2++NH4++3H2O ③ad ④防止CuCl被氧化
⑤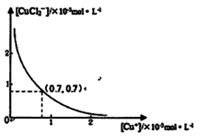
本题解析:(1)用新制Cu(OH)2与葡萄糖反应制备Cu2O,铜元素由+2价得电子生成+1价的Cu2O,作氧化剂,该反应中葡萄糖是还原剂。
(2)用H2O2稀硫酸共同浸泡废印刷电路板可制备CuSO4,若将该反应设计成原电池,铜失电子做负极,正极是H2O2得电子生成水,则正极的电极反应式为H2O2+2e-+2H+=2H2O。
(3)①硝酸铵受热分解生成氮氧化物,所以步骤I中,反应温度不宜过高的原因是防止产生氮氧化物造成污染,②用NH4NO3氧化海绵铜,铜失电子,NO3-得电子,0.5 mol NH4NO3参加反应有4mol电子转移,说明1molNO3-得8mol电子,氮元素由+5价降低到—3价,所以铜参与反应的离子方程式为4Cu+NO3-+10H+=4Cu2++NH4++3H2O,③步骤II是将硫酸铜还原成CuCl,铜元素由+2价降低到+1价,做氧化剂,需加入具有还原性的物质,且不引入杂质,a. Cu 和d. (NH4)2SO3具有还原性,能达到要求,b. C12和c. H2O2都具有强氧化性,不符,所以物质X可选用的物质是ad,④CuCl很不稳定,容易被氧化,步骤II中物质X需要过量的原因,其一是加快反应速率,其二是防止CuCl被氧化,
⑤根据①Cu Cl(s) 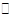 Cu+(a q) + Cl-(a q) Ksp=1.4x10-6, ② Cu Cl(s) + Cl一(a q)
Cu+(a q) + Cl-(a q) Ksp=1.4x10-6, ② Cu Cl(s) + Cl一(a q)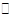 [CuCl2]-1(a q) K=0.35 ,①+②得2Cu Cl(s)
[CuCl2]-1(a q) K=0.35 ,①+②得2Cu Cl(s) 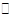 Cu+(a q)+ [CuCl2]-(a q) K=0.49×10-6,根据方程式可知:c(Cu+)·c([CuCl2]-)=0.49×10-6,两离子浓度成反比,两离子浓度相同时为0.7×10-3mol/L,据此可画出图像为:
Cu+(a q)+ [CuCl2]-(a q) K=0.49×10-6,根据方程式可知:c(Cu+)·c([CuCl2]-)=0.49×10-6,两离子浓度成反比,两离子浓度相同时为0.7×10-3mol/L,据此可画出图像为:

考点:考查葡萄糖的化学性质,用NH4NO3氧化海绵铜(含Cu和CuO)生产CuCl的工艺流程,化学图像的绘制。
本题难度:困难
4、填空题 野外铺设钢轨时,通常用铝和氧化铁混合粉末反应得到的液态铁来焊接钢轨。写出反应的化学方程式____________________________________________,该反应是_______ (填:吸或放)热反应,其中铝发生________(填:氧化或还原)反应。
参考答案:23.2Al+Fe2O3 2Fe+Al2O3,放 ,氧化
2Fe+Al2O3,放 ,氧化
本题解析:铝能和氧化铁反应生成铁和氧化铝,该反应放出大量的热,常用作焊接钢轨,铝元素由0价升高到+3价,发生氧化反应。
考点:考查铝热反应。
本题难度:一般
5、选择题 已知2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2,H2S + I2 =" 2HI" + S,下列叙述正确的是
A.氧化性:Fe3+>I2>S
B.氧化性:I2>S>Fe3+
C.还原性:Fe2+>I->H2S
D.还原性:Fe2+>H2S>I-
参考答案:A
本题解析:根据氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物可推得。氧化性:Fe3+>I2>S;而还原性:Fe2+<I-<H2S
本题难度:简单