1、选择题 下列说法不正确的是( )
A.Ksp只与难溶电解质的性质和温度有关
B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀
C.其他条件不变,离子浓度改变时,Ksp不变
D.两种难溶电解质,Ksp小的,溶解度一定小
参考答案:A.化学反应平衡常数只与反应本身的性质和温度有关,当难溶物确定时就只和温度有关了,故A正确;
B.由于Ksp(ZnS)>Ksp(CuS),在ZnS饱和溶液中加入Cu2+溶液,可生成CuS沉淀,故B正确;
C.Ksp只受温度的影响,与浓度无关,故C正确;
D.对于阴、阳离子的个数比相同即同一类型的难溶电解质,Ksp的数值越大,难溶电解质在水中的溶解能力越强即溶解度越大.对于阴、阳离子的个数比不同的难溶电解质,不能直接用Ksp的大小比较它们的溶解能力,必须通过计算进行比较,故D错误.
故选D.
本题解析:
本题难度:一般
2、选择题 工业品的MnCl2溶液含常有Cu2+、Pb2+等离子,可通过加入过量难溶电解质MnS使其中的Cu2+、Pb2+等离子形成沉淀,以制取纯净MnCl2。由此可推知MnS
[ ? ]
A.具有吸附性
B.溶解度小于CuS、PbS
C.溶解度与CuS、PbS相同
D.溶解度大于CuS、PbS
参考答案:D
本题解析:
本题难度:一般
3、选择题 已知Ag2SO4的Ksp为2.0×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,?该过程中Ag+和SO42-浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)="0.034" mol/L)。若t1时刻在上述体系中加入100 mL ?0.020 mol/L Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是 
参考答案:B
本题解析:略
本题难度:一般
4、选择题 对于难溶盐MX,其饱和溶液中的M+和X-的物质的量浓度之间的关系近似于c(H+)·c(OH-)=Kw,存在着
c(M+)·c(X-)=Ksp的关系。现将足量AgCl固体分别放入下列物质中,AgCl溶解度由大到小的排列顺序为
[? ]
①20 mL 0.01 mol·L-1KCl溶液 ②30 mL 0.02 mol·L-1CaCl2溶液 ③40 mL 0.03 mol·L-1HCl溶液
④10 mL蒸馏水 ⑤50 mL 0.05 mol·L-1AgNO3
A.①>②>③>④>⑤
B.④>①>③>②>⑤
C.⑤>④>②>①>③
D.④>③>⑤>②>①
参考答案:B
本题解析:
本题难度:一般
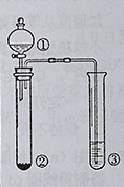
5、选择题 利用右图所示装置进行下列实验,能得出相应实验结论的是(? )
选项
| ①
| ②
| ③
| 实验结论
| 
|
A
| 稀硫酸
| Na2S
| AgNO3与AgCl的浊液
| Ksp(AgCl)>Ksp(Ag2S)
|
B
| 浓硫酸
| 蔗糖
| 溴水
| 浓硫酸具有脱水性、氧化性
|
C
| 稀盐酸
| Na2SO3
| Ba(NO3)2溶液
| SO2与可溶性钡盐均可以生成白色沉淀
|
D
| 浓硝酸
| Na2CO3
| Na2SiO3溶液
| 酸性:硝酸>碳酸>硅酸
参考答案:B
本题解析:A、①②发生反应,产生的H2S在试管中与③中的遇AgNO3与AgCl的溶液,与Ag+结合生成Ag2S沉淀,这与Ksp(AgCl)和Ksp(Ag2S)的大小无关,错误;B、浓硫酸有脱水性,能够使蔗糖脱水碳化。然后浓硫酸与C单质的反应,生成CO2和SO2,在试管中与溴水反应氧化还原反应得到硫酸和氢溴酸。因此证明了浓硫酸具有脱水性、氧化性,正确;C、SO2溶解在试管中使溶液显酸性,这时就与Ba(NO3)2溶液发生氧化还原反应得到SO42-,再发生离子反应得到硫酸钡白色沉淀。若在③中无氧化性的物质存在,则不能发生沉淀反应。错误;D、浓硝酸有挥发性,挥发出的硝酸也会与Na2SiO3溶液反应得到硅酸沉淀。因此不能证明酸性:硝酸>碳酸>硅酸。错误。
本题难度:一般
|