1、选择题 利用反应2NO(g)+2CO(g)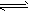 2CO2(g)+N2(g) ΔH=-746.8 kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
2CO2(g)+N2(g) ΔH=-746.8 kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
[? ]
A.降低温度
B.增大压强同时加催化剂
C.升高温度同时充入N2
D.及时将CO2和N2从反应体系中移走
2、填空题 运用化学知识解决生产、生活中的有关问题备受关注.请回答下列问题:
(1)已知水存在如下平衡:H2O?H++OH-△H>0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是______.
A.向水中加入NaHSO4固体? ?B.向水中加Na2CO3固体
C.加热至100℃[其中c(H+)=1×10-6?mol?L-1]D.向水中加入NH4Cl固体
(2)常温下,浓度均为0.1mol?L-1的下列五种钠盐溶液的pH如下表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN
pH
8.8
9.7
11.6
10.3
11.1
|
上述盐溶液中的阴离子,结合H+能力最强的是______,根据表中数据,浓度均为0.01mol?L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是______(填编号).
A.HCN?B.HClO? C.CH3COOH? D.H2CO3
(3)实验室中常用NaOH来进行洗气和提纯.当400mL?1mol?L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为______.
(4)实验室中采用惰性电极模拟工业上电解饱和食盐水的过程:
①写出C1 电极上发生反应的电极反应式______.
②当C2电极上产生112mL(标准状况)气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH=______.(Kw=10-14)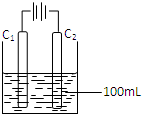
3、选择题 粗镍经过下列过程可以转化为纯度99.9%的高纯镍,发生的反应如下图,下列说法不正确的是

[? ]
A.50~80℃时,适当增大压强,有利于Ni(CO)4的生成
B.180~200℃时,气态的Ni(CO)4 会分解出纯Ni
C.温度越高,Ni(CO)4 (g)的转化率越高
D.提纯过程中,CO(g)的量不断减少
4、填空题 在一定温度下,在一体积固定的密闭中加入2mol X和1mol Y,发生如下反应:
2X(g)+Y(g)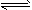 aZ(g)+W(g) △H=-Q kJ·mol-1(Q>0)(a是正整数)当反应达到平衡后,反应放出的热量为 aZ(g)+W(g) △H=-Q kJ·mol-1(Q>0)(a是正整数)当反应达到平衡后,反应放出的热量为
Q1kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值_______________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为______________。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?___________,其理由是__________________________________。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是_____________(稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr
B.a molZ、1mol W
C.1 molX、0.5mol Y、0.5a molZ、0.5 mol W
D.2 molX、1mol Y、lmolZ
(5)X的转化率α=_____________(用含Q、Q1的代数式表示)。
5、选择题 温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g)=PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:

下列说法正确的是
[? ]
A.反应在前50s的平均速率v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0molPCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
|