1、填空题 (10分)
已知下图中H是无色液体,号称生命之源,B是空气中含量最多的物质,E是红棕色气体。

(1)C的化学式是?。
(2)D和E都是大气污染物,两种物质相互转化的化学方程式分别是:
①D→E?。
②E→D?。
(3)E和H的反应中,氧化剂和还原剂的质量比是?。
(4)C和F反应生成G的化学方程式是?。
参考答案:(1)NH3
(2)D和E都是大气污染物,两种物质相互转化的化学方程式分别是:
①2NO+O2=2NO2
②3NO2+H2O=2HNO3+NO
(3)1:2
(4)HNO3+NH3=NH4NO3
本题解析:生命之源,无色液体,这两条信息可以确定H是水。A可能是氢气也可能是氧气,B为氮气。再根据C变成E,过程中都有氧气参加反应,得D为一氧化氮,E为红棕色气体二氧化氮,可以推断C应该是氨气,也得A为氢气。又由E与H反应得到F,可知F是硝酸。
(1)C的化学式依据上面的推断可得为NH3
(2)D为NO,E为NO2。相互转换的方程:①2NO+O2=2NO2②3NO2+H2O=2HNO3+NO
(3)在E和H变成F的反应中,二氧化氮发生自身氧化还原反应,氧化剂和还原剂的质量比就是其物质的量之比,为1比2。
(4)HNO3+NH3=NH4NO3
本题难度:一般
2、选择题 35.2g FeS与1000 mL 1.3mol/L硝酸溶液恰好完全反应,反应后氧化产物为Fe2(SO4)3和Fe(NO3)3,则硝酸的还原产物为(?)
A.N2
B.N2O
C.NO
D.NO2
参考答案:B
本题解析:根据题干,得知0.4mol FeS与1.3 mol硝酸恰好完全反应,据S原子守恒生成(0.4÷3)mol的Fe2(SO4)3,然后根据铁原子守恒,得知生成(0.4-0.8÷3)mol的Fe(NO3)3,则表现酸性的硝酸为3×(0.4-0.8÷3)=0.4mol,再根据N原子守恒,得出表现氧化性的硝酸为1.3-0.4="0.9" mol.最后根据电子守恒计算:0.4×9=0.9×4,可知,氮原子化合价降低4,生成N2O
本题难度:一般
3、选择题 下列物质中,氮元素的化合价最低的是
A.N2
B.NH3
C.NO
D.NO2
参考答案:B
本题解析:略
本题难度:简单
4、填空题 〔化学—选修2:化学与技术〕(15分)
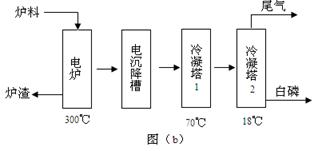
磷矿石主要以磷酸钙〔Ca3(PO4)2·H2O〕和磷灰石〔Ca3(OH)(PO4)3〕等形式存在。图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。图(b)是热法磷酸生产过各中由磷灰石制单质磷的流程。
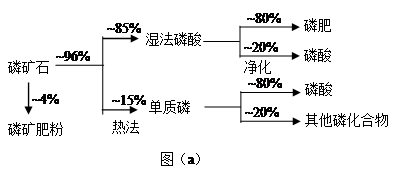
部分物质的相关性质如下:
?
| 熔点/℃
| 沸点/℃
| 备注
|
白磷
| 44
| 280.5
| ?
|
PH3
| -133.8
| -87.8
| 难溶于水,具有还原性
|
SiF4
| -90
| -86
| 易水解
|
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的? ℅。
(2)以磷灰石为原料,湿法磷酸过程中Ca3F(PO4)3反应的化学方程式为:?。现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85℅的商品磷酸?吨。
(3)如图(b)所示,热法生产磷酸的第一步是将二氧化硅、过量焦炭与磷灰石混合,高温反应生成白磷。炉渣的主要成分是:?(填化学式)冷凝塔1的主要沉积物是:?冷凝塔2的主要沉积物是:?
(4)尾气中主要含有?,还含有少量PH3、H2S和HF等,将尾气先通入纯碱溶液,可除去?
再通入次氯酸钠溶液,可除去?(均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是:??。
参考答案:(1)69; (2) Ca3F(PO4)3+5H2SO4=3H3PO4+ 5CaSO4+HF↑;0.49;(3)CaSiO3;液态白磷;固态白磷;(4)SiF4、CO;SiF4、HF、 H2S?;PH3?(5)产品纯度大(浓度大)
本题解析:(1)根据图示可知生产含磷肥料,约占磷矿石使用量的比例是0.04+0.96×0.85×0.80="0.69." (2)以磷灰石为原料,用过量的硫酸溶解Ca3F(PO4)3,可制得磷酸。根据质量守恒定律可得反应的化学方程式为Ca3F(PO4)3+5H2SO4=3H3PO4+ 5CaSO4+HF↑;根据P守恒可得关系式 P2O5~2H3PO4.142份P2O52可制取196份的磷酸。1吨折合含有五氧化二磷约30%的磷灰石,含有P2O5的质量是0.3吨,所以可制取85℅的商品磷酸是质量是(196×0.3t)÷142÷0.85="0.49t;(3)" 二氧化硅、过量焦炭与磷灰石混合,在高温下反应除了得到白磷外,得到的难溶性的固体物质是CaSiO3;冷凝塔1的温度是70℃,280. 5℃>t>44℃所以此时主要沉积物是液态白磷;冷凝塔2的温度是12℃,低于白磷的熔点,故此时主要沉积物是固态白磷。(4)根据题目提供的信息,结合反应实际,在尾气中主要含有SiF4、CO,还含有少量PH3、H2S和HF等,将尾气先通入纯碱溶液, SiF4、HF、 H2S会与碳酸钠反应而除去;再通入次氯酸钠溶液,由于次氯酸钠有强氧化性,因此可除去有还原性的PH3?。(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高。但是产品纯度大,杂质少,因此逐渐被采用。
本题难度:一般
5、填空题 氮元素及其化合物在国防科学技术生产中有重要应用。
(1)写出实验室制NH3的化学反应方程式 ?
(2)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,氢气的来源是水和碳氢化合物,写出以天然气为原料制取氢气的化学反应方程式 ? 。
(3)在合成氨的原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g) CO2 (g)+ H2 (g) △H<0,反应达到平衡后,为提高CO的转化率,可采取的措施有 ? ,已知1000K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中,c(H2O)﹕c(CO)不低于 ,
CO2 (g)+ H2 (g) △H<0,反应达到平衡后,为提高CO的转化率,可采取的措施有 ? ,已知1000K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中,c(H2O)﹕c(CO)不低于 ,
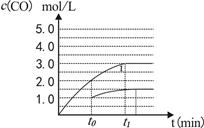
(4)在容积为2L容器中发生反应CO(g)+H2O(g) CO2 (g)+ H2 (g),已知c(CO)与反应时间t变化曲线Ⅰ
CO2 (g)+ H2 (g),已知c(CO)与反应时间t变化曲线Ⅰ

若在t0时刻将容器的体积扩大至4L,请在答题卡图中绘出c(CO)与反应时间t变化曲线Ⅱ

(5)工业上尿素CO(NH2)2由CO2和NH3在一定条件下合成,其化学反应方程式为
(6)合成尿素时,当氨碳比 =4,CO2的转化率随时间的变化关系如右图所示.
=4,CO2的转化率随时间的变化关系如右图所示.
①A点的逆反应速率v逆(CO2) B点的正反应速率为v正(CO2)(填“>”、“<”或“=”)
②NH3的平衡转化率为 。
参考答案:(1)Ca(OH)2+2NH4Cl 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
(2) CH4+H2O CO+3H2(或CH4+2H2O
CO+3H2(或CH4+2H2O ?CO2+4H2)
?CO2+4H2)
(3)适当降低温度或吸收除去二氧化碳?13.8?
(4)
(5)
(6)① <?②30%
本题解析:(1)在实验室NH3是用铵盐与碱共热制取的,化学反应方程式为:Ca(OH)2+2NH4Cl 2NH3↑+CaCl2+2H2O。(2)以天然气为原料制取氢气的化学反应方程式为CH4+H2O
2NH3↑+CaCl2+2H2O。(2)以天然气为原料制取氢气的化学反应方程式为CH4+H2O CO+3H2(或CH4+2H2O
CO+3H2(或CH4+2H2O ?CO2+4H2)(3)因为该反应是个反应前后气体体积相等的放热反应。反应达到平衡后,为提高CO的转化率可以适当降低温度或吸收除去二氧化碳或增大水蒸汽的浓度等方法。用平衡三部曲来进行计算。假设起始物中,c(H2O)为xmol/L,在反应过程中 CO的转化率最小为90%,则转化的CO的最小值为0.9xmol/L,?
?CO2+4H2)(3)因为该反应是个反应前后气体体积相等的放热反应。反应达到平衡后,为提高CO的转化率可以适当降低温度或吸收除去二氧化碳或增大水蒸汽的浓度等方法。用平衡三部曲来进行计算。假设起始物中,c(H2O)为xmol/L,在反应过程中 CO的转化率最小为90%,则转化的CO的最小值为0.9xmol/L,?
CO(g)+ H2O(g)? CO2(g)+? H2(g)
起始浓度(mol/L)? x? y? 0? 0
变化浓度(mol/L)? 0.9x? 0.9x? 0.9x? 0.9x
平衡浓度(mol/L)? 0.1x? y-0.9x? 0.9x? 0.9x,
根据平衡常数列式: ;解得
;解得 因此只要二者的比值大于13.8,转化率就会超过90%.(4)当容器的容积由2L变为4L时,反应混合物个物质的浓度都是原来的一半,浓度减小,反应速率减慢,达到平衡所需要的时间延长。由于该反应是反应前后气体体积相等的反应,所以减小压强,化学平衡不发生移动。容积四原来的2倍,则达到平衡时各物质的浓度都是原平衡的1/2.画图为:
因此只要二者的比值大于13.8,转化率就会超过90%.(4)当容器的容积由2L变为4L时,反应混合物个物质的浓度都是原来的一半,浓度减小,反应速率减慢,达到平衡所需要的时间延长。由于该反应是反应前后气体体积相等的反应,所以减小压强,化学平衡不发生移动。容积四原来的2倍,则达到平衡时各物质的浓度都是原平衡的1/2.画图为:

(5)工业上尿素CO(NH2)2由CO2和NH3在一定条件下合成,其化学反应方程式为 (6)①因为在B点时反应达到平衡,在A点还没有达到平衡。反应是从正?反应方向开始的。在达到平衡前的任何时刻,对于任何物质V正都大于V逆。所以A点的逆反应速率v逆(CO2) <B点的正反应速率为v正(CO2)。 ②假设反应开始时c(CO2)=1mol/L,则c(NH3)=4mol/L.当达到平衡时由于CO2的转化率为60%.转化浓度为: 1mol/L×60%=0.6mol/L.根据方程式可知NH3转化浓度为1.2mol/L因此NH3的平衡转化率为(1.2mol/L÷4mol/L) ×100%=30%.
(6)①因为在B点时反应达到平衡,在A点还没有达到平衡。反应是从正?反应方向开始的。在达到平衡前的任何时刻,对于任何物质V正都大于V逆。所以A点的逆反应速率v逆(CO2) <B点的正反应速率为v正(CO2)。 ②假设反应开始时c(CO2)=1mol/L,则c(NH3)=4mol/L.当达到平衡时由于CO2的转化率为60%.转化浓度为: 1mol/L×60%=0.6mol/L.根据方程式可知NH3转化浓度为1.2mol/L因此NH3的平衡转化率为(1.2mol/L÷4mol/L) ×100%=30%.
本题难度:困难