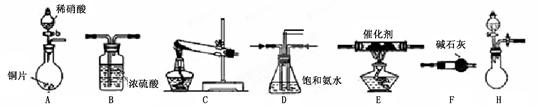
1、实验题 (15分)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用下图中的装置可以实现该反应。

回答下列问题:
(1)A中加入的物质是______________,发生反应的化学方程式是_____________。
(2)B中加入的物质是________,其作用是?。
(3)实验时在C中观察到的现象是__________________________,发生反应的化学方程式是____________________。
(4)实验时在D中观察到的现象是________,D中收集到的物质是________,检验该物质的方法和现象是________________________。
2、实验题 工业尾气中氮氧化物通常采用氨催化吸收法,其原理是NH3与NOx在催化剂作用下反应生成无毒的物质。某校活动小组同学采用以下装置和步骤模拟工业上氮氧化物的处理过程。
I.探究制取NH3的方法
(1)在上述装置中,H能快速、简便制取NH3,装置中需要添加的反应试剂为?。
(2)为探究更好的实验效果,活动小组同学采用上述C装置来制取氨气,在控制实验条件相同的情况下,获得下表中实验数据。
试剂组合序号
| 固体试剂
| NH3体积(mL)
|
a
| 6.0 g Ca(OH)2(过量)
| 5.4 g NH4Cl
| 1344
|
b
| 5.4g (NH4)2SO4
| 1364
|
c
| 6.0 g NaOH(过量)
| 5.4 g NH4Cl
| 1568
|
d
| 5.4g (NH4)2SO4
| 1559
|
e
| 6.0 g CaO(过量)
| 5.4 g NH4Cl
| 1753
|
f
| 5.4 g (NH4)2SO4
| 1792
|
?
分析表中数据,你认为哪种方案制取氨气的效果最好?(填序号),从该方案选择的原料分析制气效果好的可能原因是?。
II.模拟尾气处理
活动小组同学选用上述部分装置,按下列顺序连接成模拟尾气处理装置进行实验。
(1)请从上述装置中选择你认为合理的进行补充(所选装置不能重复)。
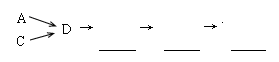
(2)A中反应的离子方程式为 ?。
(3)D装置的作用有:使气体混合均匀、调节气流速度、?。
(4)D装置中的液体还可换成?(填序号)。
a.H2O? b.CCl4? c.浓H2SO4? d.CuSO4溶液
(5)该小组同学所设计的模拟尾气处理装置中还存在一处明显的缺陷是?。
3、计算题 氨在高温下进行催化氧化以制取NO不考虑NO与O2反应)时,其
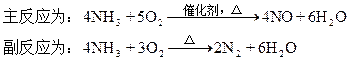
今在相同条件下将每1L氨混合10升空气后通入反应器。空气中O2和N2的体积百分含量分别以20%和80%计。上述反应完成后,测得混合气体中不含NH3,而O2与N2的物质的量之比为1∶10。试求参加主反应的氨占原料氨的体积百分含量(保留小数点后一位)。
4、选择题 工业上用废铜屑作原料制备硝酸铜。为了节约原料和防止污染环境,宜采用的方法是(? )
A.Cu + HNO3(浓) → Cu(NO3)2
B.Cu +HNO3(稀) → Cu(NO3)2
C.Cu CuO
CuO  Cu(NO3)2
Cu(NO3)2
D.Cu  CuO
CuO 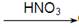 Cu(NO3)2
Cu(NO3)2
5、选择题 将3体积NO2气体依次通过三个分别装有①NaHCO3饱和溶液;②浓硫酸;③Na2O2的装置后,用排水法收集残留气体.此时气体的成分是(同温同压下测定)
A.1体积NO
B.2体积NO2和0.5体积O2
C.2体积O2
D.0.25体积O2