1、选择题 下列各组分子中,都属于含极性键的非极性分子的是
[? ]
A.CO2 H2S
B.C2H4 CH4
C.C60 C2H4
D.NH3 HCl
参考答案:B
本题解析:
本题难度:简单
2、选择题 列各组微粒,不能互称为等电子体的是
A.NO2、NO2+、NO2-
B.CO2、N2O、N3-
C.CO32-、NO3-、SO3
D.N2、CO、CN-
参考答案:A
本题解析:价电子数和原子数分别都相等的是等电子体,A中价电子数不相等;
本题难度:一般
3、选择题 以下化学用语正确的是( )
A.作为相对原子质量测定标准的碳核素:
C
B.NaCl的电子式: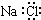
C.氯离子的结构示意图: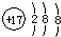
D.甲烷的分子式为:H4C
参考答案:A.作为相对原子质量测定标准的碳核素为812C,故A错误;
B.氯化钠是离子化合物,由钠离子与氯离子构成,电子式为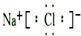 ,故B错误;
,故B错误;
C.氯原子获l1个电子形成氯离子,氯离子核外电子数为18,有3个电子层,各层电子数为2、8、8,氯离子结构示意图为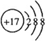 ,故C正确;
,故C正确;
D.甲烷的分子式为:CHs,故D错误;
故选C.
本题解析:
本题难度:一般
4、填空题 (每空1分,共12分)
H2O 分子构型?,中心原子采取?杂化,属于?分子(填极性或非极性)
SO3 分子构型?,中心原子采取?杂化,属于?分子(填极性或非极性)
HCN分子构型?,中心原子采取?杂化,属于?分子(填极性或非极性)
CH4 ?构型?,中心原子采取?杂化,属于?分子(填极性或非极性)
参考答案:(V型、SP3、极性)、(平面三角形、SP2、非极性)
(直线、SP、极性)、(正四面体、SP3、非极性)
本题解析:略
本题难度:简单
5、选择题 下列分子或离子的空间构型为平面三角形的是
A.SiH4
B.H3O+
C.SO32-
D.NO3-
参考答案:D
本题解析:立体构型为平面三角形的分子应含有3个δ键,且没有孤对电子,中心原子为sp2杂化,据此将进行解答。A、Si原子形成4个δ键,根据价层电子对互斥理论可知孤对电子数=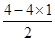 =0,所以为sp3杂化,立体构型为正四面体,因此A不选;B、O原子形成3个δ键,孤对电子数=
=0,所以为sp3杂化,立体构型为正四面体,因此A不选;B、O原子形成3个δ键,孤对电子数=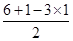 =1,所以为sp3杂化,立体构型为三角锥型,故B不选;C、S原子形成3个δ键,孤对电子数=
=1,所以为sp3杂化,立体构型为三角锥型,故B不选;C、S原子形成3个δ键,孤对电子数=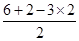 =1,所以为sp3杂化,立体构型为三角锥型,故C不选;D、N原子形成3个δ键,孤对电子数=
=1,所以为sp3杂化,立体构型为三角锥型,故C不选;D、N原子形成3个δ键,孤对电子数=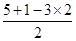 =0,所以中心原子为sp2杂化,立体构型为平面三角形,故D正确,答案选D。
=0,所以中心原子为sp2杂化,立体构型为平面三角形,故D正确,答案选D。
本题难度:一般