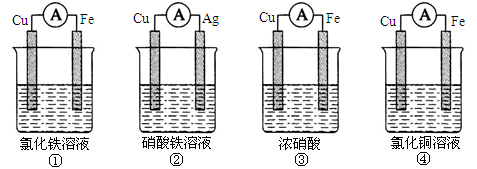
1、填空题 (10分)(1)为了验证Fe3 +与Cu2+氧化性强弱,下列装置能达到实验目的的是___________
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
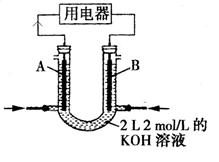
①_______处电极入口通甲烷(填A或B),其电极反应式为_______________________________
_________________________________________
②当消耗甲烷的体积为22.4L(标准状况下)时, 假设电池的能量转化率为100%,则导线中转移电子的物质的量为 ,消耗KOH的物质的量为_____________________。
参考答案:(每空2分)(1)②
(2)①A ; CH4-8e-+10OH-=CO32-+7H2O
②8mol ;? 2mol
本题解析:(1)验证Fe3+与Cu2+氧化性强弱,在原电池中,铜作负极、其它导电的金属或非金属作正极,电解质溶液为可溶性的铁盐;①中铁作负极、Cu作正极,电池反应式为Fe+2Fe3+=3Fe2+,不能验证Fe3+与Cu2+氧化性强弱,故错误;②中铜作负极、银作正极,电池反应式为Cu+2Fe3+=Cu2++2Fe2+,能验证Fe3+与Cu2+氧化性强弱,故正确;③中铁发生钝化现象,Cu作负极、铁作正极,电池反应式为:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O,不能验证Fe3+与Cu2+氧化性强弱,故错误;④中铁作负极、铜作正极,电池反应式为:Fe+Cu2+=Cu+Fe2+,不能验证Fe3+与Cu2+氧化性强弱,故错误;故选②;
(2)①根据电子流向知,A为负极、B为正极,燃料电池中通入燃料的电极为负极、通入氧化剂的电极为正极,所以A处通入甲烷,甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4-8e-+10OH-═CO32-+7H2O;
②甲烷的物质的量为1mol,导线中转移电子的物质的量=1mol×8=8mol,根据CH4-8e-+10OH-═CO32-+7H2O知,消耗KOH的物质的量为甲烷物质的量的10倍,所以消耗氢氧化钾的物质的量是10mol。
本题难度:一般
2、填空题 如图装置中,b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡.试回答:
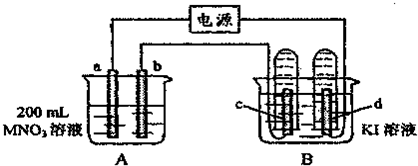
(1)a为______极,c极的电极反应式为______.
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是:______,电解进行一段时间后,罩在c极上的试管中也收集到了气体,此时c极上的电极反应为______.
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上放出了______moL气体,若b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为______g/mol.
(4)电解停止后加蒸馏水使A烧杯中的溶液体积仍为200mL,取这种溶液加入到25.0mL?0.100mol?L-1HCl溶液中,当加入31.25mL溶液时刚好沉淀完全.试计算:电解前A烧杯中MNO3溶液的物质的量浓度.______mol?L-1.
参考答案:由电解原理可得:金属M沉积于b极,说明b是阴极,则a是阳极,c是阳极,d是阴极,
(1)因a是阳极,溶液中的阴离子放电,根据离子的放电顺序,可知是I-放电:2I--2e-=I2,
故答案为:阳;2I--2e-=I2;
(2)在B烧杯中,c是阳极,溶液中的阴离子放电,即2I--2e-=I2,I2遇到淀粉能使淀粉变蓝,I-放电完毕后,
接着是OH-放电:4OH--4e=2H2O+O2↑,c极上的试管中收集到的气体为氧气,
故答案为:c极附近的溶液首先变成蓝色;4OH--4e=2H2O+O2↑;
(3)d极是溶液中氢离子放电:
? 2H++2e-=H2↑
? 0.004mol? 0.044.8L22.4L/mol?
? a极上氢氧根离子放电:
?4OH--4e=2H2O+O2↑
? 0.004mol?0.001mol?
? 即氧气的物质的量为0.001mol?
?b极上氢氧根离子放电:M++e-=M
? 0.004mol?0.004mol?
? ?则金属的摩尔质量M=mn=0.432g0.004mol?=108g/mol,
故答案为:0.001;108.
(4)设稀释后溶液的浓度为X,根据反应:Cl-+M+=MCl↓
? ? 0.100 mol/L×0.025L? X×0.03125L?
?解得X=0.08mol?L-1
? 所以200mL电解停止后加蒸馏水稀释的溶液中,M+?的物质的量为0.08mol?L-1×0.2L=0.016mol
? 则电解前A烧杯中MNO3溶液的M+?物质的量=0.004mol+0.16mol=0.004mol+0.016mol=0.02mol
? 所以MNO3溶液的物质的量浓度=0.02mol0.2Lmol/L=0.1mol/L,故答案为:0.1.
故答案为:0.1.
本题解析:
本题难度:简单
3、填空题 在A、B、C三个烧杯中分别盛有相同浓度的稀硫酸,如下图所示:
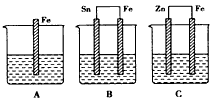
(1)A中反应的离子方程式为_________________________。
(2)B中Sn极的电极反应式为_________________________,Sn极附近溶液的pH____(填“增大”、“减小”或“不变”)。
(3)C中被腐蚀的金属是___,总反应式为__________________________(写离子方程式)。
(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是_______________。
参考答案:(1)Fe+2H+ = Fe2++H2↑
(2)2H++2e- = H2↑;增大
(3)Zn;Zn+2H+ = Zn2++H2↑
(4)B >A>C
本题解析:
本题难度:一般
4、填空题 (8分)约6cm长,2cm宽的铜片和铝片各一片,分别用接线柱平行地固定在一块塑料板上(间隔2cm),将铜片与铝片分别和电流表的“+”、“–”端相连结,电流表指针调到中间位置,取50 mL两只小烧杯,在一只烧杯中注入40mL浓HNO3,另一只烧杯中注入40mL稀硫酸,试回答下列问题:
①两电极同时插入稀H2SO4中,原电池的负极为______(填“铝”或“铜”)极,铝片上的电极反应式为:____________________________。
②两电极同时插入浓HNO3中,原电池的负极为_________(填“铝”或“铜”)极,铝片上的电极反应式为:_____________________________。
参考答案:(8分)每空各2分
铝,? Al-3e-=Al3+? Cu? NO3-+2H++e-=NO2+H2O
本题解析:(1)在电解质稀硫酸形成的原电池中,活性较强的铝为负极,失电子:Al-3e-=Al3+
(2)在电解质浓硝酸形成的原电池中,由于在常温下铝在浓硝酸中钝化,反而活性较差的铜失电子,做负极:Cu-2e-=Cul2+,溶液中的硝酸根离子在正极上得电子:NO3-+2H++e-=NO2+H2O
(可由总反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O减去负极反应面得到正极反应式)
本题难度:一般
5、填空题 人们应用原电池原理制作了多种电池,以满足不同的需要。在现代生活、生产和科学技术的发展中,电池发挥着越来越重 要的作用。以下每小题中的电池即为广泛使用于日常生活、生产和科学技术等方面的实用电池,请根据题中提供的信息,填写空格。
要的作用。以下每小题中的电池即为广泛使用于日常生活、生产和科学技术等方面的实用电池,请根据题中提供的信息,填写空格。
(1)(6分)电子表和电子计算器中所用的是钮扣式的微型银锌电池,其电极分别为Ag2O和Zn,电解液为KOH溶液。工作时电池总反应为:Ag2O+Zn+H2O=2Ag+Zn(OH)2。
①工作时电流从 极流向 极(两空均选填“Ag2O”或“Zn”)。
②电极反应式为:正极 ,负极 。
(2)(4分)蓄电池在放电时起原电池作用,在充电时起电解池的作用。爱迪生蓄电池分别在充电和放电时发生的反应 为:
为:
①放电时,正极为 。正极的电极反应式为 。
②该蓄电池中的电解质溶液应为 (选填“酸性”或“碱性”)溶液。
参考答案:(1)①电子从Zn流向Ag2O,电流流向则相反;
②正极:Ag2 O+2e-+H2O=2Ag+2OH-,负极:Zn-2e-+2 OH-= Zn(OH)2;
O+2e-+H2O=2Ag+2OH-,负极:Zn-2e-+2 OH-= Zn(OH)2;
(2)正极为NiO2,NiO2+2e-+2H2O=Ni(OH)2+2OH-;②碱性
本题解析:略
本题难度:一般