1、填空题 (海水电池)1991年我国首创以铝-空气-海水电池作为能源的新型海水标志灯,以海水为电解质,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水中数分钟,就会发出耀眼的白光,则电源负极材料为: ,正极材料为: 。正、负极反应分别为: 、 。
参考答案:负极材料为:Al;正极材料为:石墨等能导电的惰性材料或活泼性比铝弱的金属材料。
负极反应:3Al-12e—=3Al3+
正极反应:3O2+6H2O+12e—=12OH-
本题解析:根据原电池构成的条件,活泼金属作负极(失去电子),发生氧化反应;惰性材料作正极(得到电子),发生还原反应。
本题难度:一般
2、选择题 有关下列图像说法正确的是(?)
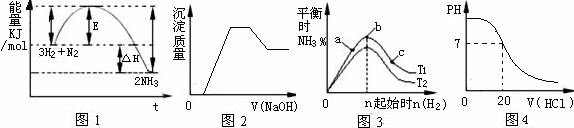
A.由图1可知合成氨反应为自发反应,加入适当的催化剂,E和△H都减小
B.图2表示向含有H+、Mg2+、Al3+、NH4+中加入NaOH溶液与产生沉淀质量的变化关系
C.图3表示合成氨反应在其他条件不变的情况下,改变起始物n(H2)对此反应平衡的影响。可知反应物N2的转化率最高的是b点;T1>T2,K2> K1(T1和T2表示温度,K1、K2表示对应温度下平衡常数)
D.图4表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水的pH随加入盐酸体积的变化
参考答案:B
本题解析:催化剂能改变活化能,但不能改变反应热,A不正确;选项B中根据图像可知,增大氢气的浓度,平衡向正反应方向移动,因此氮气的转化率增大,所以氮气转化率最高的不受b点,C不正确;氨水是弱碱,因此恰好反应时,溶液显酸性,选项D不正确,所以正确的答案选B。
本题难度:一般
3、选择题 实验室欲快速制取氢气,最好的方法应该用
A.纯锌与稀H2SO4反应
B.纯锌与浓H2SO4反应
C.粗锌与硝酸反应
D.粗锌(含Pb、Cu等杂质)与稀H2SO4反应
参考答案:D
本题解析:本题考查的是对反应速率的影响因素.影响化学反应速率的外界因素主要有:浓度、温度、压强、催化剂、接触面积等.此外若形成原电池则可加快反应速率.本题中A为正常反应,B、C发生反应时,因浓H2SO4和硝酸为氧化性酸,故不会产生H2.D中Pb、Cu与Zn可形成原电池,故制取氢气的速率可加快.
本题难度:一般
4、填空题 如图所示接通线路,反应一段时间后,回答下列问题(假设所提供的电能可以保证电解反应的顺利进行):
(1)U形管可观察到______,写出有关反应的化学方程式______;______.
(2)在小烧杯a、b中分别有什么现象产生______;
(3)如果小烧杯中有0.508g碘析出,则烧杯c中负极的质量减轻______克.
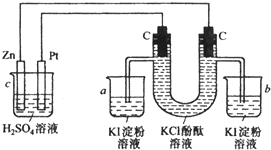
参考答案:(1)C装置能自发的进行氧化还原反应,则为原电池,锌易失电子作负极,铂丝作正极,连接铂丝的碳棒是阳极,连接锌的碳棒是阴极,阳极上氯离子放电生成氯气,电极反应式为:2Cl--2e-═Cl2↑,
所以有黄绿色气体产生,阴极上氢离子放电生成氢气,电极反应式为2H++2e-═H2↑,所以有无色气体产生,阴极附近同时生成氢氧化钾,溶液pH增大,酚酞遇碱变红色,所以阴极附近溶液呈红色,则看到的现象分别是:U形管左端有黄绿色气体产生,且溶液进入a烧杯中,U形管右端有无色气体产生且红色溶液进入b烧杯,
故答案为:U形管左端有黄绿色气体产生,且溶液进入a烧杯中,U形管右端有无色气体产生且红色溶液进入b烧杯;2Cl--2e-═Cl2↑;2H++2e-═H2↑;
(2)a中氯气和碘离子发生置换反应生成碘单质,碘遇淀粉试液变蓝色,所以a中溶液变蓝色,氢气、氢氧化钾和碘化钾溶液不反应,流入b烧杯中溶液呈红色,所以b烧杯溶液由无色变为红色,
故答案为:a烧杯溶液由无色变为蓝色,b烧杯溶液由无色变为红色;
(3)析出0.508g转移电子的物质的量=0.508g254g/mol×2=0.004mol,根据转移电子守恒可知锌减少的质量=0.004mol2×65g/mol=0.13g,
故答案为:0.13.
本题解析:
本题难度:一般
5、填空题 如下图所示,可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式〔当电解质溶液为NaOH(aq)或KOH(aq)时〕两种。试回答下列问题:
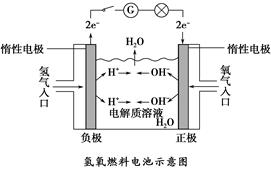
(1)酸式电池的电极反应:负极_______________,正极______________;电池总反应:________________;
电解质溶液pH的变化________(填“变大”“变小”或“不变”)。
(2)碱式电池的电极反应:负极_________________,正极_________________;电池总反应:______________;电解质溶液pH的变化________(填“变大”“变小”或“不变”)。
参考答案:(1)2H2-4e-=4H+ O2+4e-+4H+=2H2O 2H2+O2=2H2O 变大
(2)2H2-4e-+4OH-=4H2O O2+4e-+2H2O=4OH- 2H2+O2=2H2O 变小
本题解析:(1)正极上,O2得电子变为O2-,溶液中O2-不能单独存在;酸性条件下与H+结合生成H2O。负极上,H2失电子变为H+,H+进入电解质溶液。电池总反应为H2和O2生成水的反应,由于有水生成,溶液将逐渐变稀,故pH增大。
(2)正极上,O2得电子变为O2-,溶液中O2-不能单独存在,碱性条件下与H2O分子结合生成OH-;负极上,H2失去电子变为H+,碱性条件下H+不能大量存在,与OH-结合生成水。电池总反应也是H2和O2生成水的反应。同样,由于有水生成,c(OH-)变小,pH变小。
本题难度:一般