1、填空题 (14分)
某氮肥厂氨氮废水中的氮元素多以NH4+和 的形式存在,该废水的处理流程如下:
的形式存在,该废水的处理流程如下:

(1)?过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收。
①用离子方程式表示加NaOH溶液的作用:?。
②用化学平衡原理解释通空气的目的:?。
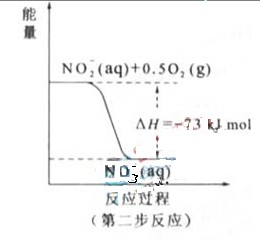
(2)?过程Ⅱ:在微生物作用的条件下,NH4+经过两步反应被氧化成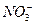 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
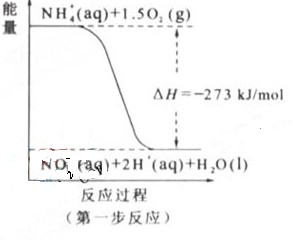
①第一步反应是?反应(选题“放热”或“吸热”),判断依据是?。
②1mol NH4+(aq)全部氧化成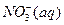 的热化学方程式是?。
的热化学方程式是?。
(3)?过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗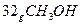 转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是?。
转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是?。
参考答案:(1)①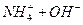

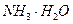
②废水中的NH3被空气带走,使 D的平衡向正反应方向移动,利于除氨
D的平衡向正反应方向移动,利于除氨
(2)①放热
△H=-273kJ/mol<0(反应为的总能量大于生成物的总能量)
②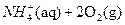


△?H=-346kJ/mol
③5:6
本题解析:略
本题难度:一般
2、选择题 下列物质反应后,产物与反应物的量无关的是(?)
A.二氧化碳与石灰水
B.盐酸与偏铝酸钠溶液
C.铝单质和氢氧化钠溶液
D.硫酸铝和氢氧化钡溶液
参考答案:C
本题解析:二氧化碳通入到石灰水中生成碳酸钙白色沉淀,CO2过量碳酸钙溶解生成碳酸氢钙;盐酸和偏铝酸钠反应生成氢氧化铝白色沉淀,盐酸过量氢氧化铝溶解;铝单质和氢氧化钠溶液反应生成氢气和偏铝酸钠,与量无关系。硫酸铝和氢氧化钠溶液反应,生成氢氧化铝白色沉淀,氢氧化钠过量,氢氧化铝又溶解在氢氧化钠溶液中,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固和训练,有利于提高学生的应试能力和学习效率。该题的关键是熟练记住常见物质的化学性质和有关反应,然后灵活运用即可。
本题难度:简单
3、填空题 (9分)㈠金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧时生成二氧化碳,反应中放出的热量如图所示:?

⑴等量金刚石和石墨完全燃烧__________(填“金刚石”或“石墨”)放出热量更多,写出表示石墨燃烧热的热化学方程式?______________________________?;
⑵在通常状况下,金刚石和石墨相比________(填“金刚石”或“石墨”)更稳定,写出石墨转化为金刚石的热化学方程式?__________________________?;
⑶12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量?。
㈡⑴家用液化气中主要成分之一是丁烷。当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50KJ。试写出丁烷燃烧反应的热化学方程式?;
⑵已知含KOH 28.0g稀溶液与足量稀硫酸反应,放出28.65KJ的热量,试写出该反应中和热的热化学方程式?。
参考答案:(一)(1)金刚石;C(石墨,s)+O2(g)=CO2(g)?△H=-393.5kJ/mol
(2)石墨;C(石墨,s)=C(金刚石,s)?△H=+9.1kJ/mol?(3)252.0kJ
(二)(1)C4H10(g)+13/2O2(g)=4CO2(g)+5H2O(l)?ΔH=-2900kJ/mol
(2)1/2H2SO4(aq)+KOH(aq)=1/2K2SO4(aq)+H2O(l)?ΔH=-57.3kJ/mol
本题解析:(一)(1)根据图像可知,金刚石的总能量高于石墨的总能量,所以等量金刚石和石墨完全燃烧金刚石放出热量更多。根据图像可知,1mol石墨完全燃烧放出的热量是110.5kJ+283.0kJ=393.5kJ,所以石墨燃烧热的热化学方程式是C(石墨,s)+O2(g)=CO2(g)?△H=-393.5kJ/mol。
(2)金刚石的总能量高于石墨的总能量,所以石墨比金刚石稳定。根据图像可知,1mol金刚石转化为石墨放出的能量是395.4kJ-393.5kJ=9.1kJ,所以石墨转化为金刚石的热化学方程式是C(石墨,s)=C(金刚石,s)?△H=+9.1kJ/mol。
(3)设生成的CO和CO2物质的量分别是和x和y,则x+y=1mol、28x+44y=36g,解得x==y=0.5mol,所以实际放出的热量是(393.5kJ/mol+110.5kJ/mol)×0.5mol=252.0kJ。
(二)(1)当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50KJ,则1mol丁烷即58g丁烷完全燃烧放出的热量是50KJ×58=2900kJ,所以反应的热化学方程式是C4H10(g)+13/2O2(g)=4CO2(g)+5H2O(l)?ΔH=-2900kJ/mol。
(2)中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量。28g氢氧化钾的物质的量是0.5mol,所以该反应的热化学方程式是1/2H2SO4(aq)+KOH(aq)=1/2K2SO4(aq)+H2O(l)?ΔH=-57.3kJ/mol。
点评:该题是高考中的常见考点,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固与训练,有助于培养学生的逻辑推理能力和应试能力,提高学生的学习效率。该题的关键是了解反应热的含义,然后结合图像灵活运用、分析、计算即可。
本题难度:一般
4、选择题 下列反应中,既属于氧化还原反应又属于吸热反应的是(? )
A.锌与硫酸反应制取氢气
B.高温条件下碳粉与二氧化碳的反应
C.高温煅烧石灰石
D.Ba(OH)2·8H2O晶体与NH4Cl固体反应
参考答案:B
本题解析:从化合价有没有改变可排除C、D,而金属与酸置换氢气的反应为放热反应,而答案为B
本题难度:一般
5、选择题 下列依据热化学方程式得出的结论正确的是(?)
A.已知2SO2(g)+O2 2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量
B.已知C(石墨,s) ===C(金刚石,s) △H>0,则金刚石比石墨稳定
C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.4 kJ/mol,则含20 g NaOH的溶液与足量稀盐酸完全反应,放出的热量为28.7 kJ
D.已知2C(s) +2O2 (g) ===2CO2(g) △H1