1、选择题 已知:①1mol?H2分子中化学键断裂时需要吸收436kJ的能量
②1mol?Cl2分子中化学键断裂时需要吸收243kJ的能量
③由H原子和Cl原子形成1mol?HCl分子时释放431kJ的能量
下列叙述正确的是( )
A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g)
B.氢气和氯气反应生成2mol氯化氢气体,反应的△H=183kJ/mol
C.氢气和氯气反应生成2mol氯化氢气体,反应的△H=-183kJ/mol
D.氢气和氯气反应生成1mol氯化氢气体,反应的△H=-183kJ/mol
参考答案:A.热化学方程式应标出反应热的数值,故A错误;
B.H2(g)+Cl2(g)=2HCl(g)的反应热=生成物的键能减反应物的键能=436kJ?mol-1+243kJ?mol-1-2×431?kJ?mol-1=-183kJ?mol-1,故1mol氢气与1mol氯气反应时放出热量为183KJ,△H=-183kJ/mol,故B错误;
C.反应热=生成物的键能减反应物的键能=436kJ?mol-1+243kJ?mol-1-2×431?kJ?mol-1=-183kJ?mol-1,故1mol氢气与1mol氯气反应时放出热量为183KJ,△H=-183kJ/mol,故C正确;
D.当生成1mol氯化氢气体时,放出的热量是原来的一半,△H=-91.5kJ/mol,故D错误.
故选C.
本题解析:
本题难度:简单
2、选择题 已知盐酸或硫酸和烧碱的稀溶液反应的热化学方程式为H+(aq)+OH-(aq)=H2O(l)?△H=-Q1 kJ/mol。又知,HF(aq)+KOH(aq)=KF(aq)+H20(l) △H=-Q2 kJ/mol
则Q1与Q2的关系正确的是(?)
A.Q1=Q2
B.Q1﹤Q2
C.Q1﹥Q2
D.无法比较
参考答案:C
本题解析:HF(aq)+KOH(aq)=KF(aq)+H20(l)? HF 是弱酸,电离时需要吸收热量,Q1﹥Q2?
选C
本题难度:一般
3、选择题 下列反应中,既属于氧化还原反应又属于放热反应的是
A.甲烷在空气中燃烧
B.生石灰与水反应
C.氢氧化钡溶液与硫酸反应
D.Ba(OH)2·8H2O晶体与NH4Cl晶体反应
参考答案:A
本题解析:B和C是放热反应,但不是氧化还原反应。D是吸热反应,所以答案选A。
点评:一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应。
本题难度:一般
4、选择题 已知某温度下: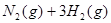

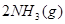 ?△H=
?△H=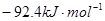 ,恒温、恒容且容积相同的两个密闭容器A、B,A中通入1molN2、3 molH 2,B 中通入0.5 molN2、1.5 mol H 2,反应一段时间后,A、B中均达到平衡状态。下列判断正确的是(?)
,恒温、恒容且容积相同的两个密闭容器A、B,A中通入1molN2、3 molH 2,B 中通入0.5 molN2、1.5 mol H 2,反应一段时间后,A、B中均达到平衡状态。下列判断正确的是(?)
A、A中放热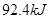 ?
?
B、B中放热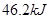 ?
?
C、A中热量变化值大于B中2倍?
D、A中热量变化值等于B中的2倍
参考答案:C
本题解析:A、B均不正确,反应热是反应完全进行所放出或吸收的热量,反应是可逆反应,不能完全进行。C、正确,A相当于对B加压后体积放大2倍,平衡正向进行,反应正向进行程度大,所以A中热量变化值大于B中2倍,D不正确。选C。
本题难度:一般
5、选择题 对于反应3A==2B,根据下图,说法不正确的是(?)
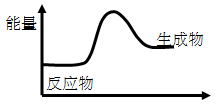
A.该反应为吸热反应
B.该反应一定有能量转化成了化学能
C.反应物比生成物稳定
D.因为生成物的总能量高于反应物的总能量,所以该反应不需要加热
参考答案:A
本题解析:A 正确,生成物的能量高于反应物的能量,是吸热反应
B 正确,把吸收的热量转变为了化学能
C 正确,能量越低越稳定,所以,反应物比生成物稳定
D 错误,此反应时吸热反应,是否需要加热,就由具体反应决定,所以不能笼统说不需要加热。
本题难度:一般