1、简答题 下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体).
请回答下列问题:
(1)能用作干燥氨气的装置有______(填字母);
(2)既能用于收集氯气又能用于收集一氧化氮气体的装置有______(填字母);
(3)在氯气和铁反应实验中,能添加在制氯气和反应装置之间以除去氯气中氯化氢等杂质气体的装置有______(填字母);
(4)能用于乙烯与溴水反应制二溴乙烷的实验装置有______(填字母);
(5)若用C装置作二氧化硫与烧杯中氢氧化钠溶液反应的实验,则其中广口瓶的作用是______.
(6)为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了下图所示的实验.
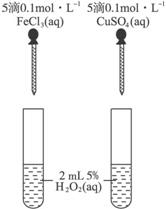
①可通过观察______现象来定性比较得出结论.
②有同学提出将CuSO4改为CuCl2更为合理,其理由是______,你认为还可以作何改进?______﹒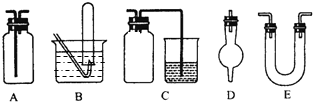
参考答案:(1)氨气为碱性气体,常用碱性干燥剂碱石灰固体干燥,而碱石灰只能填装在D、E中,故答案为:D、E;
(2)一氧化氮易与氧气反应,只能用排水法收集,只能用B,故答案为:B;
(3)除去氯气中氯化氢等杂质气体的装置应为洗气瓶,A长用作洗气瓶,故答案为:A;
(4)A装置可用作乙烯与溴水反应制二溴乙烷的实验装置,乙烯从长导管进入,瓶中装有溴水,故答案为:A;
(5)二氧化硫气体极易溶于水,要防止倒吸,C集气瓶起到安全瓶的作用,故答案为:防止倒吸;
(6)①比较反应速率的大小可通过生成气体的快慢来判断,故答案为:根据2H2O2?催化剂?.?2H2O+O2↑可知以生成气体的快慢来判断反应的快慢;
②比较不同催化剂的催化效果,应排除其它因素的干扰,故答案为:由于CuSO4、FeCl3中的阴离子不同,不能排除阴离子的因素;将FeCl3改为Fe2(SO4)3.
本题解析:
本题难度:一般
2、简答题 把0.6mol?X气体和0.6mol?Y气体混合于2L密闭容器中,使它们发生如下反应:2X(g)+Y(g)=nM(g)+2W(g).2min?末,若测知以W?的浓度变化表示的反应速率为0.05mol?L-1?min-1,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为5:4,计算:
(1)前2min内用Y的浓度变化表示的平均反应速率.
(2)2min末时X的浓度.
(3)化学反应方程式中n的值是多少?
参考答案:(1)速率之比等于化学计量数之比,V(Y)=12v(W)=12×0.05mol?L-1?min-1=0.025mol?L-1?min-1.
故答案为:0.025mol?L-1?min-1.
(2)速率之比等于化学计量数之比,V(X)=v(W)=0.05mol?L-1?min-1,
2mim内X的浓度变化为△c(X)=V(X)?△t=0.05mol?L-1?min-1×2min=0.1mol?L-1,
2min末时X的浓度c(X)=0.6mil2L-0.1mol?L-1=0.2mol?L-1.
故答案为:0.2mol?L-1.
(3)压强之比等于物质的量之比,2min末时容器内气体的总物质的量为(0.6mol+0.6mol)×54=1.5mol,
2min末时容器内X的物质的量为2L×0.2mol?L-1=0.4mol,
? 2X(g)+Y(g)=nM(g)+2W(g)? 物质的量增加
? 2mol?(2+n)-3=n-1
?(0.6-0.4)mol?(1.5-1.2)mol
即:2mol(0.6-0.4)mol=n-1(1.5-1.2)mol,解得:n=4,
故答案为:n=4.
本题解析:
本题难度:一般
3、填空题 (8分)如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中,试回答下列问题:
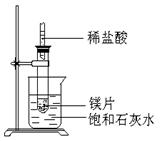
(1)实验中观察到的现象是
。
(2)产生该现象的原因
(3)写出有关反应的离子反应方程式
(4)由此推知,MgCl2溶液和H2的总能量 填(“大于”“小于”或“等于”)镁片和盐酸的总能量
参考答案:(1)向镁片表面产生气泡,逐渐减少;烧杯中有固体物质析出.
(2)镁跟盐酸反应产生氢气,并放出热量;Ca(OH)2的溶解度随温度的升高而变小.
(3)Mg+2H+
本题解析:
本题难度:一般
4、填空题 一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)

根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=
?,升高温度,K值?(填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=?
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是?
a.氢气的浓度减少? b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加? d.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:?(用化学方程式表示)。
参考答案:(1)K=c(CH3OH)/c(CO)·c2(H2)?减小
(2)2nB/3tBmol·(L·min)-1
(3)b? c
(4)Cu2O+CO 2Cu+CO2
2Cu+CO2
本题解析:此题主要考查了化学反应速率以及化学平衡。从图像可知温度高时平衡体系中甲醇含量减少,可以推出CO(g)+2H2(g) CH3OH(g)反应放热,因此温度升高后,K值减小;从图像可以看出在500℃tB时刻达到平衡,此时甲醇物质的量为nB,反应消耗氢气物质的量为2nB,可求出氢气的平均反应速率为2nB/3tBmol·(L·min)-1;加压时,反应物和生产物浓度均增大,正逆反应速率都加快,由勒夏特列原理可知,加压时平衡又移,因此答案为bc;在加热条件下CO能还原Cu2O使其减少,因此反应体系中含有少量二氧化有利于维持Cu2O的量不变。
CH3OH(g)反应放热,因此温度升高后,K值减小;从图像可以看出在500℃tB时刻达到平衡,此时甲醇物质的量为nB,反应消耗氢气物质的量为2nB,可求出氢气的平均反应速率为2nB/3tBmol·(L·min)-1;加压时,反应物和生产物浓度均增大,正逆反应速率都加快,由勒夏特列原理可知,加压时平衡又移,因此答案为bc;在加热条件下CO能还原Cu2O使其减少,因此反应体系中含有少量二氧化有利于维持Cu2O的量不变。
【思路点拨】解化学平衡问题要求考生理解平衡移动原理,改变外界条件,可不等效的影响正、逆反应速率,从而使化学平衡发生移动。
本题难度:一般
5、选择题 在密闭容器内,一定条件下发生反应A+3B?2C,在4s内,反应物A的浓度由2mol/L降到1.2mol/L,则C的反应速率为( )
A.0.2?mol?L-1?S-1
B.0.4?mol?L-1?S-1
C.0.6?mol?L-1?S-1
D.0.8?mol?L-1?S-1
参考答案:在4s内,反应物A的浓度由2mol/L降到1.2mol/L,则v(A)=2mol/L-1.2mol/L2s=0.2mol?L-1?S-1,
速率之比等于化学计量数之比,故v(C)=2v(A)=2×0.2mol?L-1?S-1=0.4?mol?L-1?S-1,
故选B.
本题解析:
本题难度:简单