1、填空题 (19分)(1)已知拆开1 mol H—H键、1 mol I—I、1 mol H—I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ,则由氢气和碘反应生成1 mol HI需要 (填“放出”或“吸收”) kJ的热量。
(2)已知在常温常压下:
①CH3OH(l)+O2(g)=CO(g)+2H2O(l);△H1=-442.8 kJ/mol
②2CO(g)+O2(g)=2CO2(g);ΔH2=-566.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式__________________________________________
(3)已知合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g);ΔH=" -92.2" kJ·mol-1
2NH3(g);ΔH=" -92.2" kJ·mol-1
下表是合成氨反应在某温度下2.0L的密闭容器中进行时,测得的数据:
 时间(h) 时间(h)
物质的量(mol)
| 0
| 1
| 2
| 3
| 4
|
N2
| 1.50
| n1
| 1.20
| n3
| 1.00
|
H2
| 4.50
| 4.20
| 3.60
| n4
| 3.00
|
NH3
| 0.00
| 0.20
| n2
| 1.00
| 1.00
|
根据表中数据计算:
①反应进行到2小时时放出的热量为 kJ。
②0~1小时内N2的平均反应速率 mol·L-1·h-1
③此条件下该反应的化学平衡常数K= (保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1mol,化学平衡向 方向移动(填“正反应”或“逆反应”或“不移动”)
2、选择题 在锌与某浓度的盐酸起反应的实验中,一个学生得到如下结果

则下列说法正确的是
[? ]
①t1=75s ②t2>200>t3 ③单位时间内消耗的锌的质量mG>mF>mB
A.①
B.①②
C.只有②
D.全部正确
3、填空题
|
|
废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是___________(填字母)。
A.热裂解形成燃油 B.露天焚烧 C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)====Cu2+(aq) +H2(g) △H=+64.39kJ/mol
2H2O2(l)====2H2O(l)+O2(g) △H=-196.46kJ/mol
H2(g)+1/2O2(g)====H2O(l) △H=-285.84kJ/mol
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化方程式为________________________。
(3)控制其他条件相同,印刷电路板的金属粉末用10﹪H2O2和3.0mol·L-1 H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
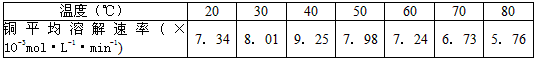
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是___________________。
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是_____________________。
4、选择题 (2分)下图表示在密闭容器中反应:CO2(g)+C(s) 2CO(g)△H>0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是?;bc过程中改变的条件可能是?;
2CO(g)△H>0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是?;bc过程中改变的条件可能是?;

5、选择题 在2A+B  ?3C+4D反应中,表示该反应速率最快的是(?)
?3C+4D反应中,表示该反应速率最快的是(?)
A.v(A)=0.5 mol·L-1·s-1? B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1? D.v(D)=1 mol·L-1·s-1