1、选择题 在存放照相机、显微镜、食品和药品的包装盒中常发现一些袋装透明的胶状颗粒,该颗粒的主要作用是干燥,其成分是
A.活性炭
B.氯化钠
C.硅胶
D.小苏打
参考答案:C
本题解析:以上四种物质中只有硅胶是干燥剂。
本题难度:困难
2、填空题 (14分)在氯化银的表面负载银纳米颗粒后将具有优秀的光催化性能,可用于光催化降解污水中的有机污染物。某课题组利用如下流程制备这种光催化剂,并同时获取新型净水剂高铁酸钠。
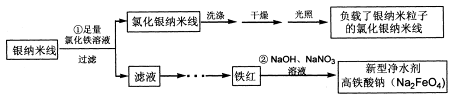
(1)写出①反应的离子方程式______________
(2) 过滤得到氯化银纳米线须洗涤干净后再进行光照。检验氯化银纳米线是否洗净的操作方法是____________________________
(3) 反应②的离子方程式是
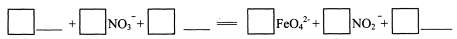
(4) 由21.60g银纳米线得到了25.15g最终产物,则产物中银纳米粒子的质量分数是_______。(计算结果保留两位小数)
参考答案:(1)Fe3+ + Ag + Cl- ="==AgCl+" Fe2+(3分)
(2)取最后少量洗涤液,滴加KSCN溶液(或检验Cl-,其它合理答案均给分)。(3分)
(3)1 Fe2O3 + 3 NO3- + 4OH- ="==" 2 FeO42- + 3 NO2- + 2H2O?(4分)
(4)43%或0.43(4分)
本题解析:(1)从工艺流程图中可以分析出反应①为Fe3+氧化Ag,则离子方程式为
Fe3+ + Ag + Cl- ="==AgCl" + Fe2+
(2)考查沉淀是否洗净的标志,关键是找出可能附着的可溶性离子。本题可以检验最后一次洗涤液中有无Fe3+或Cl-。
(3)本题涉及氧化还原反应缺项配平,依据流程图找出所缺的物质,再进行配平即可。
(4)可以用差量法找出增加的质量为氯元素的质量,依据氯元素的质量求出AgCl的质量。即可求出产物中银纳米粒子的质量分数。
本题难度:一般
3、填空题 【化学—选修2:化学与技术】(15分)
化学是人类进步的关键,化学为人类的生产、生活提供了物质保证。
Ⅰ.氮的化合物是重要的化工产品。其生产方法也在逐渐改进中,各国科学家均在为提高其产量,降低能耗做各种有益的探究。
(1)25℃时合成氨反应热化学方程式为:N2(g)+3H2(g)==2NH3(g),ΔH="-92.4kJ/mol" 。在该温度时,取1molN2和3molH2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4kJ。其原因是_________________________________。
(2)近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了较好的产率。从化学反应本质角度分析,电磁场对合成氨反应的作用是??;与传统的合成氨的方法比较,该方法的优点是?。
Ⅱ.(3)卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从卤水中提取镁的步骤为:
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;
d.将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
e.电解熔融的氯化镁可得到Mg。
①步骤d中的“一定条件”指的是?。?
②有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,你同意该同学的想法吗?为什么??
(4) 铀是核反应最重要的燃料,已经研制成功一种螫合型离子交换树脂,它专门吸附海水中?的U4+,而不吸附其他元素。其反应原理为?(树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为:?。
参考答案:(15分)(1)该反应是可逆反应,反应不完全(1分)
(2)在电磁场的作用下氮氮叁键更容易断裂,降低了合成反应所需的能量,反应容易进行。(2分)节能减排,降低了设备要求。(2分)
(3)①在HCl气流中(2分)?②不同意,因为MgO熔点很高,熔融时因耗费大量的能量而增加生产成本(2分)
(4)4HR+U4+=UR4+4H+ (3分)? UR4+4H+=4HR+U4+ (3分)
本题解析:(1)该反应是可逆反应,反应物不会全部转化为生成物;
(2)电磁场存在的条件下,合成氨的温度、压强都比较低,说明电磁场的作用使反应的活化能降低,反应容易进行;因为反应的条件降低,所以这种方法对设备的要求不高,而且节能减排;
(3)①MgCl2水解生成氢氧化镁和氯化氢,加热,促进水解,为防止其水解,MgCl2·6H2O在氯化氢的气流中加热得到无水MgCl2,所以一定条件是指在HCl气流中;
②不同意;因为氧化镁的熔点较高,电解熔融的氧化镁需要的能量大,增加成本,所以不能电解氧化镁,而电解氯化镁;
(4)根据题意可知树脂HR只吸附U4+,所以与氢离子发生交换,反应原理为4HR+U4+=UR4+4H+ ;
发生离子交换后的离子交换膜用酸处理,再次发生离子交换,得到含铀的溶液,反应原理为UR4+4H+=4HR+U4+ 。
本题难度:一般
4、选择题 有关高温结构陶瓷和光导纤维的说法正确的是
[? ]
A.高温结构陶瓷弥补了金属材料的弱点,但是硬度却远远低于金属材料
B.氮化硅陶瓷是一种重要的结构材料,具有超硬性,它不与任何无机酸反应
C.光导纤维能够高质量的传导光信息
D.光导纤维的抗干扰性能好,不发生电辐射,通讯质量高
参考答案:CD
本题解析:
本题难度:简单
5、选择题 在熔融状态下,Na与KCl存在可逆反应:Na+KCl NaCl+K,通过调整温度,可利用金属Na来制取K。
NaCl+K,通过调整温度,可利用金属Na来制取K。
物质
| K
| Na
| KCl
| NaCl
|
熔点(℃)
| 63.6
| 97.8
| 770
| 801
|
沸点(℃)
| 774
| 883
| 1 500
| 1 413
|
?
根据上表的熔点和沸点,确定由Na与KCl反应制取K的合适温度为(?)
A.770℃?B.801℃
C.850℃?D.770℃~801℃
参考答案:C
本题解析:K、Na的活泼性相近,要从上述可逆的置换反应中制取K,主要是利用K的沸点比Na的低而控制温度使K气化。其余三种物质均为液体,便于生成的K蒸气不断逸出,使反应向生成K的方向进行而制得K。应在801℃~883℃间合理。
本题难度:一般