1、选择题 锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为(? )
A.2mol
B.1 mol
C.0.5mol
D.0.25mol
参考答案:D
本题解析:根据得失电子数相等,生成1 mol硝酸锌时,锌失去2mol电子,设有Xmol硝酸被还原,N元素由+5价降到—3价,8X=2?解得X=0.25mol,故选D
本题难度:一般
2、计算题 (12分)(1)在浓硝酸中放入铜片。
①开始反应的化学方程式为___________________________________
②若铜有剩余,则反应将要结束时的反应的离子方程式是?。
③待反应停止后,再加入少量的25%的稀硫酸,这时铜片上又有气泡产生,其原因是
_____________________________________________________。
(2) 在100mL混合酸中,c(HNO3) = 0.4mol·L-1,c(H2SO4) = 0.2mol·L-1,向其中加入2.56g铜粉,微热,待充分反应后,溶液中Cu2+的物质的量浓度为?。
(3)14g铜银合金与过量的某浓度的硝酸溶液反应,待放出的气体与1.12L(标准状况下)氧气混合通入水中,恰好全部被水吸收,则合金中铜的质量是?。
参考答案:(12分)
(1)① Cu + 4HNO3(浓)= Cu(NO3)2 + 2NO2↑ + 2H2O (2分)
②3Cu + 8H+ + 2NO3- =3Cu2+ + 2NO↑ + 4H2O(2分)
③再加入稀H2SO4,H+与NO3―构成了氧化条件。(2分)
(2)0.15mol·L-1?(3分)
(3)3.2g(3分)
本题解析:(1)铜与硝酸反应与其浓度有关:
Cu + 4HNO3(浓)= Cu(NO3)2 + 2NO2↑ + 2H2O
3Cu + 8HNO3(稀)="3" Cu(NO3)2 + 2NO↑ + 4H2O
③待反应停止后,再加入少量的25%的稀硫酸提供H+,溶液中的NO3-可继续氧化铜
(2)NO3-、H+、Cu均为0.04mol,结合下面的离子方程式:
3Cu ?+ ?8H+?+?2NO3- =3Cu2+ + 2NO↑ + 4H2O
0.015mol? 0.04mol? 0.01mol? 0.015mol
溶液中Cu2+的物质的量浓度为0.15mol·L-1
(3)设合金中铜为x mol,银为 y mol
由合金质量可知:64x+108y=14?由电子守恒可得:2x+y=4×11.2/22.4
x=0.05mol? y=0.1mol
所以铜为3.2g
本题难度:一般
3、选择题 把盛有NO2和N2的混合气体的试管倒立在盛水的水槽中,最终液面上升到距试管底部2/3处,则原混合气体中NO2和N2的体积比是
A.1∶1
B.1∶2
C.2∶1
D.3∶1
参考答案:A
本题解析:3NO2+H2O=2HNO3+NO,由题意可知气体体积缩小了1/3,所以NO2的体积为1/2体积,N2为1/2体积,则原混合气体中NO2和N2的体积比是1∶1。2与水反应
点评:本题主要采用体积差进行计算。
本题难度:一般
4、选择题 某单质跟足量浓硝酸反应时(还原产物只有NO2)每有0.5mol的单质反应就消耗2molHNO3,则单质中的元素氧化后的化合价可能是下列中的:
①+1?②+2?③+3?④+4
A.②
B.④
C.②④
D.①③
参考答案:C
本题解析:也就是说每有1mol的单质反应就消耗4molHNO3
设A与硝酸反应后得到的硝酸盐中为+n价,则硝酸盐为A(NO3)n,由化合价的升降守恒得:
n=(4-n)×1,求得n=2
如果A为非金属,它与硝酸反应后呈n价,则由化合价升降守恒可知:n=4
故答案为C
本题难度:一般
5、填空题 硝酸铵是一种常用的化肥,其工业生产流程如下图,请回答下列问题。
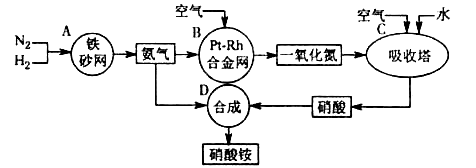
⑴写出反应容器B中发生反应的化学方程式:?。
⑵吸收塔C中通入空气的目的是?;C、D两个反应容器中发生的反应,属于氧化还原反应的是?(填反应容器代号)。
⑶浓硝酸一般保存在棕色试剂瓶里,并放置在阴凉处,用化学方程式解释原因:?。?
⑷金属铜与稀硝酸反应的离子方程式是?,该反应中稀硝酸表现的性质是?。
参考答案:⑴4NH3+5O2 4NO+6H2O?⑵将一氧化氮氧化成二氧化氮?;? C?
4NO+6H2O?⑵将一氧化氮氧化成二氧化氮?;? C?
⑶4HNO3 4NO2↑+O2↑+2H2O?⑷3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O?酸性和氧化性
4NO2↑+O2↑+2H2O?⑷3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O?酸性和氧化性
本题解析:氮气与氢气在铁触媒的作用下反应产生氨气,氨气在Pt-Rh合金作用下加热被空气中的氧气氧化为NO和水,NO在吸收塔中与氧气反应产生二氧化氮气体,二氧化氮被水吸收得到硝酸和NO。硝酸与氨气作用形成硝酸铵。⑴反应容器B中发生反应的化学方程式为4NH3+5O2 4NO+6H2O;⑵在吸收塔C中通入空气的目的是为了将一氧化氮氧化成二氧化氮;在C中发生反应:2NO+O2=2NO2;3NO2+ H2O == 2HNO3+ NO。在D中发生反应:HNO3+NH3=NH4NO3.前两个反应是氧化还原反应,第三个不是氧化还原反应。所以属于氧化还原反应的容器为C。(3)浓硝酸不稳定,光照容易分解,温度越高越容易分解,为防止浓硝酸的分解,常把浓硝酸保存在棕色玻璃瓶中,放在冷暗处。分解的方程式为4HNO3
4NO+6H2O;⑵在吸收塔C中通入空气的目的是为了将一氧化氮氧化成二氧化氮;在C中发生反应:2NO+O2=2NO2;3NO2+ H2O == 2HNO3+ NO。在D中发生反应:HNO3+NH3=NH4NO3.前两个反应是氧化还原反应,第三个不是氧化还原反应。所以属于氧化还原反应的容器为C。(3)浓硝酸不稳定,光照容易分解,温度越高越容易分解,为防止浓硝酸的分解,常把浓硝酸保存在棕色玻璃瓶中,放在冷暗处。分解的方程式为4HNO3 4NO2↑+O2↑+2H2O 。⑷硝酸有强氧化性,不仅能把活泼的金属氧化,还能把不活泼的金属如Cu氧化。金属铜与稀硝酸反应化学方程式为:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O?其离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。在该反应中一部分硝酸中的N由+5价变为+2价,得到电子,被还原,表现氧化性,还有一部分化合价没有变化,提供酸根离子用来形成硝酸盐,起酸的作用。故硝酸的作用是酸性和氧化性。
4NO2↑+O2↑+2H2O 。⑷硝酸有强氧化性,不仅能把活泼的金属氧化,还能把不活泼的金属如Cu氧化。金属铜与稀硝酸反应化学方程式为:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O?其离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。在该反应中一部分硝酸中的N由+5价变为+2价,得到电子,被还原,表现氧化性,还有一部分化合价没有变化,提供酸根离子用来形成硝酸盐,起酸的作用。故硝酸的作用是酸性和氧化性。
本题难度:一般