1、填空题 (1)Fe(OH)3胶体制备,是向沸腾的蒸馏水中加入几滴饱和FeCl3溶液并继续加热至液体变成红褐色,写出制备Fe(OH)3胶体的化学方程式______,Fe(OH)3胶体中常混有FeCl3和HCl,将其装入半透膜袋,浸入蒸馏水中进行分离,该分离方法称为______,若在盛有红褐色Fe(OH)3胶体的U形管的两个管口插上电极,并通直流电,一段时间后,______极(填阴、阳)颜色变深.
(2)分类方法是研究物质和化学反应的重要方法.
对HCl(盐酸)、H2SO4(硫酸)、HNO3(硝酸)、H3PO4(磷酸)、H2S(氢硫酸)进一步分类时有多种分类角度,根据某些标准进行分类.
①根据某分类标准,只有一种物质与HCl同属一类,该物质是______,分类标准是______
②氧化钙、氢氧化钙分别与盐酸反应的共同点是______,由此可得出氧化钙属于碱性氧化物.根据上述信息的启示,N2O5与氢氧化钠溶液反应的离子方程式是______.
参考答案:(1)制备胶体的原理是利用铁离子水解生成氢氧化铁胶体,反应的化学方程式为:FeCl3+3H2O═Fe(OH)3(胶体)+3HCl;Fe(OH)3胶体中常混有FeCl3和HCl,分离应采用渗析的方法;Fe(OH)3胶粒吸附了正电荷,通直流电一段时间,向阴极移动,阴极附近的颜色逐渐变深,故答案为:FeCl3+3H2O═Fe(OH)3(胶体)+3HCl;渗析;阴;
(2)①H2S和HCl都是无氧酸,H2SO4(硫酸)、HNO3(硝酸)、H3PO4(磷酸)都是含氧酸;故答案为:H2S;是否是无氧酸;
②氧化钙、氢氧化钙分别与盐酸反应都生成盐和水;N2O5与氢氧化钠溶液反应:N2O5 +2NaOH═2NaNO3+H2O,离子方程式:N2O5 +2OH-═2NO3-+H2O,故答案为:都生成盐和水;N2O5 +2OH-═2NO3-+H2O;
本题解析:
本题难度:简单
2、填空题 相对分子质量为M的某物质在室温下的溶解度为S g,此时测得饱和溶液的密度为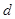 g/cm3,则该饱和溶液的物质的量浓度为
g/cm3,则该饱和溶液的物质的量浓度为
参考答案:
本题解析:室温下该物质的溶解度为S g的物质的量为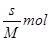 ,溶液的体积为
,溶液的体积为 ,故该饱和溶液的物质的量浓度为
,故该饱和溶液的物质的量浓度为 。
。
考点:物质的量浓度计算
点评:考查物质的量浓度计算,难度不大,解题时要找出计算所需的化学量,注意溶液的总质量是(100+S),而不是S。
本题难度:一般
3、选择题 下列关于胶体的说法正确的是
[ ? ]
A.胶体外观不均匀
B.胶体不能通过滤纸
C.胶体都能产生丁达尔效应
D.胶体不稳定,静置后容易产生沉淀
参考答案:C
本题解析:
本题难度:简单
4、选择题 下列分散系能产生丁达尔效应的是( )
A.硫酸铜溶液
B.稀硫酸
C.溴水
D.氢氧化铁胶体
参考答案:A.硫酸铜溶液不是胶体,不能产生丁达尔效应,故A错误;
B.稀硫酸不属于胶体,不能产生丁达尔效应,故B错误;
C.溴水属于溶液,不是胶体,不能产生丁达尔效应,故C错误;
D.Fe(OH)3胶体能产生丁达尔效应,故D正确.
故选D.
本题解析:
本题难度:简单
5、选择题 下列关于胶体的叙述正确的是( )
A.向煮沸的NaOH溶液中滴加FeCl3溶液可制备Fe(OH)3胶体
B.利用丁达尔效应区别NaCl溶液和K2S04溶液
C.用过滤操作不能从溶液和胶体的混合物中分离出胶体
D.布朗运动是胶体微粒特有的运动方式,据此可以把胶体、溶液和悬浊液区别开
参考答案:A、氢氧化铁胶体制备是向沸水中滴加FeCl3溶液制备Fe(OH)3胶体,滴入氢氧化钠溶液在生成氢氧化铁沉淀,故A错误;
B、丁达尔现象是区别溶液和胶体的方法,NaCl溶液和K2S04溶液需要用焰色反应鉴别,故B错误;
C、溶液和胶体都能通过滤纸,用过滤操作不能从溶液和胶体的混合物中分离出胶体,需要用渗析方法分离,故C正确;
D、把胶体、溶液和悬浊液区别开的依据是分散质微粒直径,故D错误;
故选C.
本题解析:
本题难度:简单