1、选择题 下列关于卤素(用X表示)叙述正确的是
A.其单质在常压下的沸点,随着卤素核电荷数的增多逐渐升高
B.单质和水反应通式是:X2 + H2O=HX + HXO,剧烈程度随着核电荷数的增多而减弱。
C.单质和氢气反应的通式是:X2 + H2= 2HX(条件不同),剧烈程度随着卤素核电荷数的增多而减弱,所生成的氢化物的稳定性降低
D.随着卤素核电荷数的增多,单质的氧化性逐渐增强,阴离子还原性逐渐减弱
参考答案:AC
本题解析:A正确,B不正确,单质氟和水反应生成HF和氧气;同主族自上而下非金属性逐渐降低,氢化物的稳定性逐渐减弱,C正确;随着卤素核电荷数的增多,单质的氧化性逐渐减弱,阴离子还原性逐渐增强,D不正确,答案选AC。
点评:该题是中等难度的试题,试题紧扣教材,主要是考查学生灵活运用元素周期律解决实际问题的能力,有利于培养学生的逻辑推理能力,提高学生分析、归纳、总结问题的能力,提升学生的学科素养。
本题难度:一般
2、实验题 实验室用MnO2和浓盐酸制取氯气并验证氯气的部分性质,实验装置如下图所示。
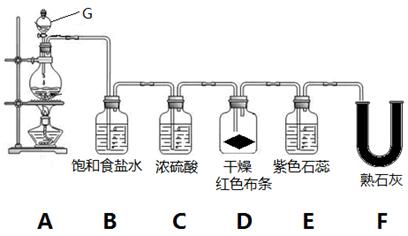
(1)G装置名称___________________。A装置的离子反应化学方程式是?,氧化剂与还原剂的物质的量之比为?。
(2)B装置的作用是_____________。
(3)实验开始几分钟后,D装置红布条是否褪色__________,E装置中观察到的现象是_____________
_____________________________________________________________。
(4)装置F中发生反应的化学方程式是_____________________________________________________。(5)F装置后应再连接一个尾气处理装置,装置里加入NaOH溶液,尾气处理的离子反应方程式为_____
____________________________________________________。
参考答案:(1)分液漏斗(1分)?MnO2+4H++2Cl- Mn2++Cl2↑+2H2O(2分)?1:2?(1分)
Mn2++Cl2↑+2H2O(2分)?1:2?(1分)
(2)除氯气中的氯化氢(1分)?(3) 不褪色,?(1分)?先变红后褪色?(1分)
(4)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O?(2分) (5)Cl2+2OH-=Cl-+ClO-+H2O?(2分)
本题解析:(1)根据装置的特点可知,G装置是分液漏斗;A装置是制备氯气的,反应的离子反应方程式是MnO2+4H++2Cl- Mn2++Cl2↑+2H2O。其中二氧化锰中Mn元素的化合价从+4价降低到+2价,得到2个电子,二氧化锰是氧化剂。氯化氢中氯元素的化合价从-1价升高到0价,失去1个电子,氯化氢是还原剂。根据电子得失守恒可知,氧化剂与还原剂的物质的量之比是1:2。
Mn2++Cl2↑+2H2O。其中二氧化锰中Mn元素的化合价从+4价降低到+2价,得到2个电子,二氧化锰是氧化剂。氯化氢中氯元素的化合价从-1价升高到0价,失去1个电子,氯化氢是还原剂。根据电子得失守恒可知,氧化剂与还原剂的物质的量之比是1:2。
(2)由于浓盐酸易挥发,生成的氯气中含有氯化氢,所以B装置的作用是除氯气中的氯化氢。
(3)由于生成的氯气先经过浓硫酸被干燥,干燥的氯气不能使有色布条褪色,所以实验开始几分钟后,D装置红布条不褪色。氯气溶于水生成盐酸和次氯酸,溶液具有酸性和强氧化性,所以E装置中观察到的现象是先变红后褪色。
(4)氯气是酸性气体,与熟石灰反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
(5)氯气有毒需要尾气处理,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
本题难度:一般
3、选择题 下列关于液氯和氯气的说法正确的是?
[? ?]
A.液氯和氯气不是同种物质
B.标准状况下Cl2的密度为3.17 g.L-1
C.液氯不导电,是非电解质,氯气能导电,是电解质
D.液氯是混合物,氯气是纯净物
参考答案:B
本题解析:
本题难度:简单
4、选择题 用如图所示装置进行下列实验,放置一段时间后,实验结果与预测的现象不一致的是( )
| ①中的物质 | ②中的物质 | 预测现象
A
浓盐酸
浓氨水
装置内出现白烟
B
酚酞溶液
浓硝酸
①中溶液变红
C
淀粉KI溶液
饱和氯水
①中溶液变蓝
D
饱和硫酸铜溶液
浓硫酸
①中溶液析出蓝色晶体
|
A.A
B.B
C.C
D.D