1、选择题 在新研制的超导材料中,铊(Tl)是主要组成元素之一.已知铊为ⅢA族原子序数最大的金属元素,则下列关于铊元素性质的推测,不正确的是( )
A.是银白色较软的金属
B.Tl(OH)3与Al(OH)3相似,也是两性氢氧化物
C.可以形成氧化物Tl2O3
D.与酸反应比铝剧烈
参考答案:A.Al为银白色金属,则Tl是银白色较软的金属,故A正确;
B.同主族从上到下金属性在增强,Al(OH)3为两性氢氧化物,则Tl(OH)3为碱性氢氧化物,故B错误;
C.ⅢA族元素的最高价为+3价,则可以形成氧化物Tl2O3,故C正确;
D.同主族从上到下金属性在增强,则Tl与酸反应比铝剧烈,故D正确;
故选B.
本题解析:
本题难度:简单
2、推断题 A、B、C、D、E、F六种短周期元素的原子序数依次增大。A、D同族,B、C同周期;C是F不同周期的邻族元素;B原子最外层电子数比其次外层电子数多2;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和;E和F的原子序数之和为30。由上述六种元素中的两种元素组成的甲、乙、丙、丁、戊、己六种化合物如下图所示:?
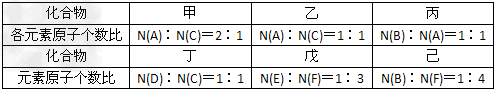
请回答下列问题:
(1)化合物己的电子式___________。
(2)向含有1mol乙的水溶液中加入MnO2,该反应中电子转移的物质的量为_________?mol。
(3)化合物丙中所有的原子都在同一直线上,实验室制取丙的化学方程式为__________。
(4)F的单质与甲反应的离子方程式为____________。
(5)将丁与二氧化碳反应生成的盐置于戊的水溶液中,发生反应的离子方程式为_____________。
参考答案:(1)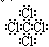 ?
?
(2)1?
(3)CaC2+2H2O→Ca(OH)2+CH≡CH↑
(4)Cl2+H2O=H++Cl-+HClO
(5)3CO32-+2Al3++3H2O=2Al(OH)3↓+3CO2↑
本题解析:
本题难度:一般
3、选择题 已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,但是W的气态氢化物的稳定性比Z的气态氢化物的稳定性强,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是
A.XYZW的原子半径依次减小
B.W与X形成的化合物中只含离子键
C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
参考答案:A
本题解析:试题分析:W、Z同主族且W的气态氢化物的稳定性比Z的气态氢化物的稳定性强,说明W在Z的上一周期。X、Y、Z同周期,X、Y为金属元素且X的阳离子的氧化性小于Y的阳离子的氧化性,说明原子序数为:W<X<Y<Z,原子半径X>Y>Z>W,A正确。若W为O,X为Na,形成的化合物Na2O2中既含有离子键又含有共价键,B错误。若W为C,Z为Si,则气态氢化物的沸点CH4<SiH4,C错误。若W与Y的原子序数相差5,则有可能形成Al2O3或Mg3N2,D错误。
考点:元素周期律及物质的性质
点评:考查元素周期律和物质的性质,具有一定的难度,解题的关键是结合题干信息,判断各元素在元素周期表的位置,结合选项逐一排除。
本题难度:一般
4、选择题 下列说法正确的是
A.Xm+和Yn-与氖的电子层结构相同,原子半径前者大于后者
B.NaF和MgF2中阳离子与阴离子半径之比,前者小于后者
C.O2-和O原子的核外电子数,前者小于后者
D.PH3和H2S的稳定性,前者大于后者
参考答案:A
本题解析:
本题难度:困难
5、选择题 含有4个原子核,10个电子的微粒是:
A.CH4
B.NH4+
C.H3O+
D.PH3
参考答案:C
本题解析:AB是含有5个原子核的10电子微粒,D是18电子微粒。所以正确的答案是C。
本题难度:困难