1、填空题 .(21分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  ?2NH3(g)?△H= -92.4KJ/mol?,据此回答以下问题:
?2NH3(g)?△H= -92.4KJ/mol?,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号)?。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应的活化能降低,加快反应速率
d.活化分子间所发生的碰撞为有效碰撞
e.降低温度,V正、V逆均减小且V正减小的倍数小于V逆减小的倍数。
f.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=_______________________。
②根据温度对化学平衡影响规律知,对于该反应,温度越高,其平衡常数的值越_____ 。
(3)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________(可用分数表示)。能说明该反应达到化学平衡状态的是?(填字母)。
a.容器内的密度保持不变?
b.容器内压强保持不变?
c.υ正(N2)=2υ逆(NH3)?
d.混合气体中c(NH3)不变
e.容器内混合气体的平均摩尔质量保持不变
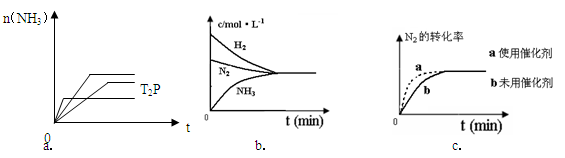
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_____________。
 (5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
参考答案:(1)a、c、f、e、?(4分)
(2)①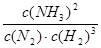 ?(2分)?②小? (2分)
?(2分)?②小? (2分)
(3)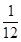 ?(2分)?;b、d 、e(全对3分,选对1个给1分,错选0分)
?(2分)?;b、d 、e(全对3分,选对1个给1分,错选0分)
(4)ac? ………(2分)(5) a<b? Q1<Q2? Q1< 92.4?(各2分)
本题解析:(1)增大压强能增大单位体积内活化分子百分数,所以能增大反应速率,b不正确。活化分子间所发生的碰撞不一定都是有效碰撞,把能够发生化学变化的碰撞称为有些碰撞,d不正确,其余都是正确的,答案选acef。
(2)①平衡常数是在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度幂之积的比值,所以表达式为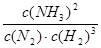 。
。
②正反应是放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小。
(3)? N2(g)+3H2(g)  ?2NH3(g)
?2NH3(g)
起始量(mol)? 10? 30? 0
转化量(mol)? x? 3x? 2x
平衡量(mol)? 10-x? 30-3x? 2x
所以有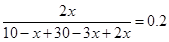
解得x=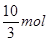
所以平衡常数为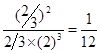
在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以D正确。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,a不正确。反应是体积减小的,所以压强也是减小的,b正确。C中反应速率的方向相反,但不满足速率之比是相应的化学计量数之比,不正确。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以d可以说明。答案选bde。
当反应平衡时,物质的浓度不一定是相等的,b不正确。催化剂不能改变平衡状态,所以c正确,温度越高,压强越大,达到平衡的时间就越少,a正确,答案选ac。
(5)因为反应是体积减小的,所以压强也是减小,即B中压强高于A中的,所以B中反应物的转化率高,放出的热量也多,氨气的含量也高。但反应是可逆反应,所以转化率得不到100%,因此不可能92.4kJ热量。
本题难度:一般
2、选择题 合成氨工业中控制的反应条件应? ( )。
A.温度越高越好
B.压强越大越好
C.混合气体中氢气含量越高越好
D.所选的催化剂活性越大越好
参考答案:D
本题解析:工业合成氨的热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,似乎压强越大就越有利于平衡向合成氨的方向移动,温度越高达到平衡的时间就越短,易错选A或B。实际上在合成氨的工业生产中,压强不能太大,否则能耗太高,并且对设备的要求高。而根据化学平衡移动原理,此反应温度越低越有利于平衡向正方向移动,但温度太低,则催化剂的催化活性不能很好地发挥,反应速率太慢;为解决上述矛盾,一般选择使
2NH3(g) ΔH=-92.4 kJ·mol-1,似乎压强越大就越有利于平衡向合成氨的方向移动,温度越高达到平衡的时间就越短,易错选A或B。实际上在合成氨的工业生产中,压强不能太大,否则能耗太高,并且对设备的要求高。而根据化学平衡移动原理,此反应温度越低越有利于平衡向正方向移动,但温度太低,则催化剂的催化活性不能很好地发挥,反应速率太慢;为解决上述矛盾,一般选择使
催化剂活性最大时的温度。
本题难度:一般
3、填空题 《化学与技术》
20-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)下列有关工业生产的叙述正确的是?(?)
A.合成氨生产过程中将NH3液化分离,可以提高N2、H2转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
E.炼铁过程中碳被氧化,既起产生热量的作用,又起产生CO的作用
20-2.(14分)海南省是海洋大省,海水是人类宝贵的自然资源,从海水中可以提取多种化工原料,下图是某工厂对海水资源综合利用的示意图:

(1)请列举海水淡化的两种方法?、?。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br -,其目的是:?。
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式
?
(3)在制取无水氯化镁时需要在干躁的HCl气流中加热MgCl2.6H2O的原因
?
(4)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以
用做镁蒸气的冷却剂的是(?)
A.H2? B.CO2?
C.空气? D.O2? E.水蒸气
(5)从各种经营综合开发,打造大而强的现代企业以及本厂生产所需要的原料等方面来
看,你认为该化工厂还可以再增加的生产项目的?。
参考答案:20-1(6分)ADE
20-2(14分)
(1)蒸馏法、电渗析法、离子交换法及其他合理答案中的任意两种(各1分共2分)
(2)富集溴元素(2分)Br2+SO2+2H2O==4H++SO2-4+2Br-(3分)
(3)在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2,6H2O
受热产生的水汽,故能得到无水MgCl2。(3分)
(4)A(2分)
(5)建一个盐酸汤(2分)
本题解析:略
本题难度:一般
4、选择题 在H2SO4、HNO3、NH3的工业生产中,具有的共同点是
A.使用H2作原料
B.使用催化剂
C.使用吸收塔设备
D.使用尾气吸收装置
参考答案:B
本题解析:A、H2SO4不用H2作原料,错误;B、SO2到SO3需要催化剂,NH3的合成与氧化需要催化剂,正确;C、NH3的合成不使用吸收塔设备,错误;D、工业生产中原料充分利用,一般有毒气体较少排放,错误。
本题难度:一般
5、选择题 在接触法产生H2SO4的过程中,对“废气、废水、废渣、废热”的处理正确的是( )
①废气用氨水处理 ②污水用石灰乳处理 ③废渣用来造水泥或炼铁 ④设置“废热”锅炉产生蒸气来供热或发电
A.只有①②
B.只有①③④
C.只有①②③
D.全部
参考答案:D
本题解析:SO2等废气可以用氨水吸收制得化肥硫酸铵等;污水显酸性可以用石灰乳处理;炉渣和矿灰可作为炼铁的原料;硫酸工业的反应都是放热反应,不但可以自行提供能量,还可以向外界提供能量,以降低成本。
本题难度:一般