1、实验题 纯碱( Na2CO3)在工业生产和生活中有重要应用,其实验室制法和工业制法如下:
Na2CO3)在工业生产和生活中有重要应用,其实验室制法和工业制法如下:
【实验室制备纯碱】
(1)将饱和NaCl溶液倒入烧杯中加热,控制温度为30—35℃
(2)搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟
(3)静置、过滤得NaHCO3晶体
(4)用少量蒸馏水洗涤、抽干
(5)将所得固体转入蒸发皿中灼烧得 Na2CO3固体
Na2CO3固体
问题:
①反应将温度需控制在30—35℃,通常采取的加热方法为?;控制该温度的原因是??;
②静置后只析出NaHCO3晶体的原因是?。
【工业制备纯碱】
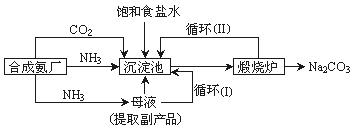
③沉淀池中反应的离子方程式为 ?;
④循环(I)、 循环(Ⅱ)中物质的化学式分别为 ?。
两种制备纯碱的方法中,共同涉及的化学反应方程式为?。
参考答案:①水浴加热(2分)
防止NH4HCO3分解而影响NaHCO3晶体的生成(2分)
②碳酸氢钠溶解度最小(2分)
③Na++NH3+H2O+CO2 = NaHCO3↓+NH4+(3分)
④NaCl、CO2(3分) ?2NaHCO3 ?Na2CO3+ CO2↑+ H2O?(3分)
?Na2CO3+ CO2↑+ H2O?(3分)
本题解析:略
本题难度:简单
2、填空题 硫铁矿与焦炭充分混合(FeS2与C的质量比为5∶2),在有限量的空气中缓慢燃烧,结果可得到硫磺(副产物是两种氧化物),其燃烧的方程式是_____________________________。
参考答案:2FeS2+8C+5O2====2FeO+8CO+4S或3FeS2+12C+8O2====Fe3O4+12CO+6S
本题解析:根据质量比算出FeS2与C的物质的量之比是1∶4,产物除单质硫外,一是铁的氧化物,二是碳的氧化物(CO),由于焦炭是还原剂且空气是限量的,不会生成高价铁的氧化物。
本题难度:简单
3、选择题 下列说法正确的是
A.联合制碱法的优点是减少了对设备的腐蚀
B.工业生产硫酸时,用98%硫酸的来吸收三氧化硫,可以避免形成酸雾并提高吸收率
C.合成氨是天然固氮的方法之一
D.碳酸钠俗称小苏打,甲烷是一种清洁能源
参考答案:B
本题解析:
本题可以采用排除法。由于联合制碱法增加了物质的循环利用,所以会加重“对设备的腐蚀”,A错误。合成氨是目前人工固氮的主要方法。而不是天然固氮,C错;小苏打,又叫碳酸氢钠,甲烷是一种清洁能源,但是不能减缓温室效应,故D错。排除后选B,我们一般用98%硫酸的来吸收三氧化硫,可以避免形成酸雾并提高吸收率,这是正确的。直接用水吸收SO3的话会形成酸雾,降低SO3的吸收率。
本题难度:简单
4、实验题 (15分)高纯氧化铁(α—Fe2O3)是现代电子工业的重要材料。实验室用硫铁矿烧渣(主要成分为Fe2O3、FeO,还含有SiO2等杂质)为原料制备高纯氧化铁的步骤如下:

回答下列问题:
 ?(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式:?。
?(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式:?。
(2)实验室欲用18.4mol·L-1的浓硫酸配制100mL 5.0mol·L-1的硫酸
溶液,所用的玻璃仪器胶头滴管、量筒、烧杯、玻璃棒外,还有
?(填写仪器名称)。
(3)某同学用右图所示装置进行过滤操作。
①请指出其中的错误之处:?;
②过滤后,洗涤过滤器中少量沉淀的方法是?。
(4)某同学用下图所示装置(尾气吸收装置未画出)实验向溶液Y中通入NH3和CO2
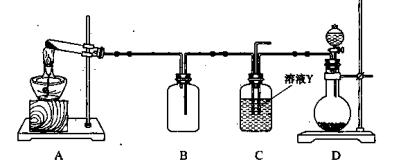
①下列为实验室制备NH3和CO2的备选药品:
a.NH4Cl? b.CaCO3(块状)? c.Ca(OH)2?d.NaOH
e.浓氨水? f.稀盐酸? g.稀硫酸
则上述装置A处的试管中所放药品的最佳选择为?和?(用药品序号填空);装置D处药品的最佳选择为?和?(用药品序号填空)。
②下列各项制备实验中,也可利用装置D处仪器完成的是?(填序号)。
A.MnO2与浓盐酸反应制备Cl2
B.Cu与浓硫酸反应生成SO2
C.由KMnO4分解制O2
D.乙醇与乙酸反应制备乙酸乙酯