1、选择题 叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是()
A.HN3水溶液中粒子浓度大小顺序为:c(HN3)>c(H+)>c(N-3)>c(OH-)
B.HN3与NH3作用生成的叠氮酸铵是共价化合物
C.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N-3)>c(OH-)>c(H+)
D.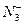 与CO2含相等电子数
与CO2含相等电子数
参考答案:B
本题解析:由于HN3和CH3COOH酸性相似,类比CH3COOH溶液及CH3COONa溶液中的离子浓度的大小关系可知A、C皆正确,而由CH3COONH4为离子化合物(盐)可知HN3与NH3反应所形成的为铵盐,是离子化合物,B不正确;经计算可知D正确,答案为B。
本题难度:简单
2、填空题 pH=2的某酸HnA与pH=12的某碱B(OH)m等体积混合后溶液的pH=8。
(1)写出正盐的化学式:______________________________。
(2)若该盐中只有一种离子水解,该离子水解的离子方程式为_________________________。
(3)简述该混合液呈碱性的原因。
参考答案:(1)BnAm
(2)Bm++mH2O B(OH)m+mH+
B(OH)m+mH+
(3)等体积混合时,酸中的n(H+)与碱中的n(OH-)(溶液中)完全中和,pH=8说明碱为弱碱,H++OH-====H2O后,继续电离。
本题解析:因为酸的pH与碱的pH之和等于14,等体积混合后pH=8>7,说明碱为弱碱,Bm+水解的离子方程式是:Bm++mH2O B(OH)m+mH+。HnA与B(OH)m等体积混合后,已电离的H+与OH-完全中和,弱碱继续电离产生OH-,显碱性。
B(OH)m+mH+。HnA与B(OH)m等体积混合后,已电离的H+与OH-完全中和,弱碱继续电离产生OH-,显碱性。
本题难度:简单
3、选择题 下列叙述正确的是
[? ]
A.用核磁共振氢谱可以鉴别1-溴丙烷和2-溴丙烷
B.对于可逆反应N2(g)+3H2(g)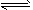 2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增大
2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增大
C.将AlCl3溶液和NaAlO2溶液分别蒸干后灼烧,所得固体产物均为Al2O3
D.BaSO4在相同物质的量浓度的Na2SO4和Al2(SO4)3溶液中的溶解度相同
参考答案:A
本题解析:
本题难度:一般
4、选择题 下列离子因水解相互促进而不能共存的是()
A.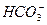 、Na+、Cl-、OH-
、Na+、Cl-、OH-
B.Al3+、Na+、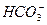 、
、
C.H+、Fe2+、 、Cl-
、Cl-
D.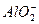 、K+、
、K+、 、Al3+
、Al3+
参考答案:BD
本题解析:解决本题的关键是判断溶液中是否同时存在弱酸的酸根和弱碱的阳离子。A选项中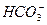 与OH-因发生复分解反应不能大量共存。B选项中Al3+与
与OH-因发生复分解反应不能大量共存。B选项中Al3+与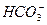 因相互促进水解而不能大量共存:Al3++3
因相互促进水解而不能大量共存:Al3++3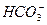 ====Al(OH)3↓+3CO2↑。C选项中Fe2+与H+、
====Al(OH)3↓+3CO2↑。C选项中Fe2+与H+、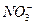 因发生氧化还原反应不能大量共存。D选项中Al3+与
因发生氧化还原反应不能大量共存。D选项中Al3+与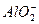 因相互促进水解不能大量共存:Al3++3
因相互促进水解不能大量共存:Al3++3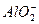 +6H2O====4Al(OH)3↓。
+6H2O====4Al(OH)3↓。
本题难度:简单
5、选择题 有关①100ml 0.1 mol/L 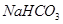 、②100ml 0.1 mol/L
、②100ml 0.1 mol/L 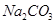 两溶液叙述不正确的是
两溶液叙述不正确的是
A.溶液中水电离出的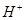 个数:②>①
个数:②>①
B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中: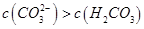
D.②溶液中: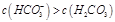
参考答案:C
本题解析:
选项A:因HCO3-的水解程度大于其电离程度,所以NaHCO3溶液显碱性;由于CO32-水解使得
Na2CO3溶液也显碱性。根据越弱越水解原理可知,HCO3-的水解程度小于CO32-,弱离
子水解程度越大,对水的电离程度,所以相同浓度的NaHCO3和Na2CO3溶液中,水电
离出的H+个数:②>①,所以A正确
选项B:HCO3-水解生成H2CO3和OH-,即消耗一个HCO3-的同时又生成一个OH-,水解的过程?
中阴离子数不变;
但CO32-的第一级水解生成HCO3-和OH-,即消耗一个CO32-的同时却生成了两个阴离
子,水解的过程中,阴离子总数在增加;由于起始时CO32-和HCO3-的浓度相同,所以
溶液中阴离子的物质的量浓度之和:②>①,所以B正确
选项C:因HCO3-的水解程度大于其电离程度,所以①溶液中:c(H2CO3)>c(CO32-)
所以C错
选项D:CO32-的第一级水解生成HCO3-,第二级水解生成H2CO3,且以第一级水解为主,所以②
溶液中:c(HCO3-)>c(H2CO3),所以D正确
本题难度:简单