1、填空题 有X、Y、Z三种元素,其中Y、Z为短周期元素,;X元素在周期表的第五周期,X的负价阴离子的原子核外电子排布与氙的原子核外电子排布相同;Z和X的原子最外层电子数相等;Y有两种氧化物,其水溶液都呈碱性,其氧化物的摩尔质量分别是62g/mol和78g/mol.在X和Y化合生成物的水溶液中滴入淡黄绿色的Z单质的水溶液,溶液由无色变成深黄色.试回答:
(1)元素符号:X______,Y______,Z______.
(2)Y的两种氧化物为______和______.写出此两种氧化物与水反应的化学方程式______;______.
(3)Z的单质溶于水,滴加到X和Y形成的化合物的水溶液中,可发生反应,该反应的离子方程式为______.
(4)写出Y和Z形成的化合物的电子式:______;Z单质分子的电子式:______.
参考答案:X元素在周期表的第五周期,X的负价阴离子的原子核外电子排布与氙的原子核外电子排布相同,X和Y化合生成物的水溶液中滴入淡黄绿色的Z单质的水溶液,溶液由无色变成深黄色,则X为I;Z和X的原子最外层电子数相等,均为ⅤⅡA族元素,Z为短周期元素,且与碘离子发生氧化还原反应,则Z为Cl;Y有两种氧化物,其水溶液都呈碱性,其氧化物的摩尔质量分别是62g/mol和78g/mol,氧化物分别为Na2O、Na2O2,则Y为Na,
(1)X为I,Y为Na,Z为Cl,故答案为:I;Na;Cl;
(2)Na的两种氧化物分别为Na2O、Na2O2,分别与水反应的方程式为Na2O+H2O═2NaOH、2Na2O2+2H2O═4NaOH+O2↑,
故答案为:Na2O;Na2O2;Na2O+H2O═2NaOH;2Na2O2+2H2O═4NaOH+O2↑;
(3)氯气与NaI溶液反应置换出单质碘,离子反应为Cl2+2I-═2Cl-+I2,故答案为:Cl2+2I-═2Cl-+I2;
(4)NaCl为离子化合物,电子式为
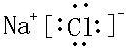
,氯气的电子式为
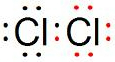
,
故答案为:
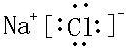
;
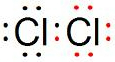
.
本题解析:
本题难度:一般
2、选择题 X、Y为短周期元素,X原子各电子层的电子数比为1:4:1,它比Y原子多3个电子.下列叙述正确的是( )
A.X离子半径大于Y离子半径
B.X单质在空气中燃烧可生成两种化合物
C.X、Y形成的化合物与浓硫酸共热可在烧瓶中进行
D.电解X、Y形成的化合物的水溶液可得Y的单质
参考答案:B
本题解析:
本题难度:简单
3、选择题 已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构.下列关于X、Y、Z、W四种元素的描述,不正确的是( )
A.原子半径:X>Y>W>Z
B.原子序数:Y>X>Z>W
C.原子最外层电子数:Y>X>Z>W
D.金属性:X>Y,还原性:W2->Z-
参考答案:X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构,则X、Y处于同一周期,原子序数Y>X;Z、W处于同一周期,且处于X、Y所在周期上一周期,原子序数Z>W,所以原子序数Y>X>Z>W;
A、Z、W处于同一周期,且处于X、Y所在周期上一周期,原子序数Y>X>Z>W,同周期元素原子序数越大,半径越小,所以原子半径X>Y,W>Z,原子核外电子层数越多,半径越大,所以X>Y>W>Z,故A正确;
B、X、Y处于同一周期,原子序数Y>X,Z、W处于同一周期,且处于X、Y所在周期上一周期,原子序数Z>W,所以原子序数Y>X>Z>W,故B正确;
C、X、Y处于同一周期,原子序数Y>X,则原子最外层电子数Y>X;Z、W处于同一周期,原子序数Z>W,则原子最外层电子数Z>W,X、Y形成阳离子,Z、W形成阴离子,所以最外层电子数Z>W>Y>X,故C错误;
D、X、Y处于同一周期,形成阳离子,原子序数Y>X,所以金属性:X>Y;Z、W处于同一周期,形成阴离子,原子序数Z>W,所以非金属性Z>W,非金属性越强,阴离子还原性越弱,所以还原性:W2->Z-,故D正确.
故选:C.
本题解析:
本题难度:一般
4、选择题 下列有关NaH的叙述中正确的是
[? ]
A.NaH在水中显酸性
B.NaH中氢离子的电子层排布与氦原子的相同
C.NaH中氢离子具有还原性
D.NaH中氢离子可被还原成氢气
参考答案:BC
本题解析:
本题难度:简单
5、简答题 有X、Y、Z三种主族元素形成的3种离子X(n+1)+,Y?m-,Z?m+,已知m>n,X(n+1)+比Z?m+多一个电子层,Z与Y同周期,则进行下列推断:
(1)X、Y、Z三种原子的原子半径由大到小的顺序是______>______>______.
(2)X(n+1)+、Y?m-、Z?m+三种离子的半径由大到小的顺序是______>______>______.
(3)三种元素最高价氧化物对应水化物碱性依次减弱,酸性依次增强的顺序是______.
参考答案:有X、Y、Z三种主族元素形成的3种离子X(n+1)+,Y?m-,Z?m+,X、Z为金属元素,Y为非金属元素.Z与Y同周期,则原子序数Y>Z.已知m>n,X(n+1)+比Z?m+多一个电子层,则X位于Y、Z所在周期的下一周期,最外层电子数X与Z相等,或Z比X多.
(1)由上述分析可知,Z为金属元素,Y为非金属元素,Z与Y同周期,原子序数Y>Z,同周期,原子序数越大,原子半径越小,所以原子半径Z>Y;X位于Z的下一周期,电子层越多,原子半径越大,则原子半径X>Z,故原子半径X>Z>Y,故答案为:X>Z>Y;
(2)X位于Y、Z所在周期的下一周期,所以X(n+1)+与Y?m-具有相同电子层,电子层排布相同,核电荷数越大,离子半径越小,所以离子半径Y?m->X(n+1)+;X(n+1)+比Z?m+多一个电子层,最外层电子数相同,电子层越多,离子半径越大,所以离子半径X(n+1)+>Z?m+,所以离子半径Y?m->X(n+1)+>Z?m+,
故答案为:Y?m->X(n+1)+>Z?m+;
(3)X(n+1)+比Z?m+多一个电子层,则X位于Y、Z所在周期的下一周期,最外层电子数X与Z相等,或Z比X多,所以金属性X>Z,Z为金属元素,Y为非金属元素,所以三种元素按X,Z,Y顺序金属性减弱,非金属性增强,三种元素最高价氧化物对应水化物碱性依次减弱,酸性依次增强的顺序是XZY,
故答案为:XZY.
本题解析:
本题难度:一般