1、选择题 反应:L(s)+aG(g) bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。
bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。
据此可判断
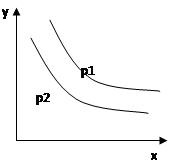
A.上述反应是放热反应 B.上述反应是吸热反应
C.a>b D.无法判断a,b大小
参考答案:B
本题解析:根据图像可知,随温度的升高,G的含量逐渐降低,说明升高温度,平衡向正反应方向移动,因此正反应是吸热反应,A不正确,B正确。当温度相同时,压强越大G的含量越高,说明增大压强,平衡向逆反应方向移动,所以a小于b,选项CD不正确,答案选B。
本题难度:一般
2、选择题 充分说明反应P(g)+Q(g)?R(g)+S(g)在恒温下已达到平衡的是( )
A.反应容器内的压强不随时间改变
B.反应容器内P、Q、R、S四者共存
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化
参考答案:A、该反应为体积不变的反应,反应过程中气体的总物质的量始终不变,所以压强始终不变,压强不能作为判断平衡状态的标志,故A错误;
B、任何的可逆反应中,反应物和生成物都同时存在,无法判断是否达到平衡状态,故B错误;
C、P的生成速率和S的生成速率相等,为正逆反应速率相等,达到了平衡状态,故C正确;
D、该反应方程式两边气体的物质的量不变,所以反应容器内气体的总物质的量始终不变,气体的总物质的量不能作为判断达到平衡状态的标准,故D错误;
故选C.
本题解析:
本题难度:一般
3、填空题 (14分)向一密闭容器中加入2mol A、0.6molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3-t4阶段为使用催化剂;图一中t0-t1阶段c(B)未画出。

(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)= 。
(2)t4-t5阶段改变的条件为 ,B的起始物质的量为 。
该反应方程式可表示为
各阶段平衡时对应的平衡常数如下表所示:
t1—t2
| t2—t3
| t3—t4
| t4—t5
| t5—t6
|
K1
| K2
| K3
| K4
| K5
|
则K1= (保留两位小数),K1、K2、K3、K4、K5之间的关系为
K1 K2 K3 K4 K5 (用“>”、“<”或“=”连接)
(3)在相同条件下,若起始时容器中加入a molA、bmolB和cmolC,要达到t1时刻同样的平衡(各物质的百分含量相同),a、b、c要满足的条件为 。
(含a,b,c的代数式表示)
参考答案:
(1) 0.02 mol/(L.min)
(2) 减压(或扩大容器体积) 1mol 2A+B 3C
3C
0.84 = = = <
(3) a:b="2:1" c ≥0
本题解析:1、根据反应速率的计算公式即可计算出v(C)="0.02" mol/(L.min),注意单位不能省。
2、根据图表可以初步分析出A为反应物C为生成物,再根据t4-t5阶段改变的条件,速率都减小,而平衡未移动,说明不是降温,也不是改变了浓度,所以只能是降压,或者体积减小,可以推断出该反应为气体体积不变的反应,由此可以推算出反应式为 2A+B 3C ,首先根据C的起始浓度与物质的量计算出容器体积为2L,所以A反应掉了0.2*2=0.4mol,B反应了0.2mol,最后B剩余0.4*2=0.8mol,所以起始物质的量为1mol。
3C ,首先根据C的起始浓度与物质的量计算出容器体积为2L,所以A反应掉了0.2*2=0.4mol,B反应了0.2mol,最后B剩余0.4*2=0.8mol,所以起始物质的量为1mol。
根据平衡常数=生成物的浓度的序数次幂/反应物的浓度的序数次幂,根据图表可以计算出各个阶段的反应平衡常数,又因为反应的平衡常数只与温度有关,当反应的温度保持不变时,反应的平衡常数保持不变。最后一个阶段,升温,使平衡正移,所以平衡常数最大。
3、根据反应前后体积不变的反应,要达到等效平衡只需要反应物的浓度之比等于原始浓度之比即可,所以要达到等效平衡只要a:b="2:1" c ≥0
考点:化学反应速率的计算,影响化学平衡的因素,等效平衡的条件。
点评:本题难度适中,主要考察了化学平衡的判断及计算,理解平衡常数只与温度有关及等效平衡的条件是解题的关键,另外还需要仔细看图,看清图像的横纵坐标,不要忽略图像信息。
本题难度:困难
4、选择题 在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) 2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下
2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下
表:
t/min
| 2
| 4
| 7
| 9
|
n(Y)/mol
| 0.12
| 0.11
| 0.10
| 0.10
|
下列说法正确的是
A.该温度下此反应的平衡常数K=1.44
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
C.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
D.其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大
参考答案:A
本题解析:A、由表中数据可知反应进行到7min时达到平衡,此时Y的物质的量浓度是0.010mol/L,根据化学方程式可知,X的平衡物质的量浓度也是0.010mol/L,则Z的平衡物质的量浓度是2(0.016-0.010)=0.012mol/L,所以K=0.0122mol/L/0.0102mol/L=1.44,正确;B、该反应是放热反应,所以降低温度,平衡正向移动,再达平衡前,ν(逆)<ν(正),错误;C、反应前2min的平均速率ν(Y)=(0.16-0.12)mol/10L/2min=0.002mol·L-1·min-1,则ν(Z)=2ν(Y)=0.004 mol·L-1·min-1,错误;D、该反应是反应前后气体的物质的量不变的可逆反应,所以气体条件不变,再充入0.2molZ,再达平衡与原平衡是等效平衡,X的体积分数不变,错误,答案选A。
考点:考查化学平衡的移动的判断,平衡常数的计算
本题难度:一般
5、选择题 若过程I与过程II温度相同,则关于反应N2O4(g)? 2NO2?(g)在下列过程中发生的变化描述正确的是
2NO2?(g)在下列过程中发生的变化描述正确的是

[? ]
A.a"?<b"、a?>b?
B.在平衡I向平衡II过渡的过程中,v(逆)?<v(正)
C.a">a、b"<b?
D.平衡II与平衡IV中N2O4的质量分数相等
参考答案:D
本题解析:
本题难度:一般