| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《原电池原理》考点强化练习(2020年押题版)(十)
 参考答案:A、①的阳极反应:2Cl-=Cl2+2e-,导线中通过0.02mol电子时,产生氯气的体积V=nVm=0.01mol×22.4L/mol=0.0224L,②中的正极反应为:2H++2e-=H2↑,导线中通过0.02mol电子时,产生氢气的体积V=nVm=0.01mol×22.4L/mol=0.0224L,所以产生气体的体积:①=②,故A错误; 本题解析: 本题难度:简单 2、选择题 关于下列各图的说法,正确的是( ) 参考答案:A、①装置是电解池,阴极是溶液中阳离子得到电子发生还原反应,应是氢离子得到电子生成氢气,故A错误; 本题解析: 本题难度:简单 3、选择题 如图甲把锌片和铜片用导线相连后插入硫酸铜溶液构成原电池.某实验兴趣小组做完实验后,在读书卡上的记录如图=2*ZODIAC1 乙所示,则卡片上的描述合理的是( ) |

参考答案:①该原电池中锌失电子变成锌离子进入溶液,所以锌作负极,铜作正极.故正确.
②锌失电子变成锌离子进入溶液,锌片逐渐溶解,所以锌片质量减少,溶液中铜离子得电子生成铜附着在铜极上,所以铜片质量增加,故错误.
③锌失电子通过导线流向铜,所以铜片上有大量电子,根据异性电荷相吸,所以溶液中氢离子向Cu极移动,硫酸根离子向锌极移动,故错误.
④锌失电子通过导线流向铜,所以电子流向为由Zn经导线流入Cu片,故正确.
⑤溶液中铜离子得电子生成铜析出,硫酸根离子不参加反应,所以铜离子浓度减小,硫酸根离子浓度不变,故错误.
⑥铜作正极,正极上铜离子得电子生成铜,电极反应式为Cu2++2e-=Cu,故正确.
故选B.
本题解析:
本题难度:简单
4、选择题 关于如图装置说法正确的是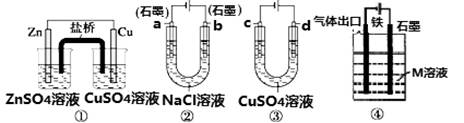
A.装置①中,盐桥中的K+移向ZnSO4溶液
B.装置②工作一段时间后,a极附近溶液的OH-的浓度增大
C.用装置③精炼铜时,c极为粗铜
D.装置④中若M是海水,该装置是通过“牺牲阳极保护法”使铁不被腐蚀
参考答案:B
本题解析:A.装置①是原电池,根据同种电荷相互排斥,异种电荷相互吸引的原则,盐桥中的K+移向负电荷加多的CuSO4溶液,错误;B.装置②在电解NaCl溶液的过程中,工作一段时间后,由于a极H+不断放电变为氢气逸出,所以附近溶液的OH-的浓度增大,正确;C.用装置③精炼铜时,c极为精铜,d为粗铜,错误;D.装置④中若M是海水,该装置是通过外加电源的阴极保护法使铁不被腐蚀,错误。
考点:考查原电池、电解池、电镀、金属的腐蚀与保护的知识。
本题难度:一般
5、选择题 有关如图装置的叙述不正确的是( )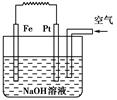
A.这是电解NaOH溶液的装置
B.该装置中Pt为正极,电极反应为O2+2H2O+4e-=4OH-
C.该装置中Fe为负极,电极反应为Fe+2OH-=Fe(OH)2+2e-
D.这是一个原电池装置
参考答案:A
本题解析:没有电源,属于原电池,A不正确。铁比Pt活泼,属于铁是负极,失去电子,Pt是正极,溶液中的氧气得到电子,发生吸氧腐蚀,所以选项BCD都是正确的,答案选A。
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《酯》练习题 | |