1、选择题 下列物质中,分别加入少量溴水,振荡后静置,水溶液呈无色的是
A.NaOH溶液
B.NaCl溶液
C.KI溶液
D.四氯化碳
参考答案:AD
本题解析:A、Br2与NaOH溶液反应,生成NaBrO、NaBr和水,故溴水褪色,正确;B、溴水与NaCl溶液混合时不反应,故不褪色,错误;C、Br2与KI反应,生成KBr和I2,溶液的颜色加深,错误;D、四氯化碳从水中溶解、分离出I2,液体分层后,水层褪色,正确。
本题难度:一般
2、填空题 (12分)氮元素可形成卤化物、叠氮化物及络合物等。
(1)NF3构型为三角锥体,沸点-129 ℃;可在铜催化作用下由F2和过量NH3反应得到。
NF3属于? ?晶体,写出制备 NF3的化学反应方程式:? ???。
(2)氢叠氮酸(HN3)是一种弱酸,它的酸性类似于醋酸,微弱电离出H+和N3-。
①与N3-互为等电子体的分子、离子有:? ?、? ?(各举1例),由此可推知N3-的空间构型是? 型。
②叠氮化物、氰化物能与Fe3+及Cu2+及Co3+等形成络合物,如:[Co (N3)(NH3)5]SO4、
Fe(CN)64-。写出钴原子在基态时的价电子排布式:? ?。
[Co (N3)(NH3)5]SO4中钴的配位数为? ?,CN—中C原子的杂化类型是? ?。
(3)化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中一种异构体可溶于水,则该异构体是?(填“极性”、“非极性”)分子。
(4)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是???(选填序号)
A.NaN3与KN3结构类似,前者晶格能较小
B.第一电离能(I1):N>P>S
C.钠晶胞结构如图,该晶胞分摊2个钠原子

D.氮气常温下很稳定,是因为氮的电负性小
参考答案:(1)分子? 4NH3+3F2 ===NF3+3NH4F?(2分)
(2)①N2O(CO2或CS2);? SCN—(CNO—),?直线
② 3d74s2?6 ?sp杂化(3)极性(4)B C?(2分)
本题解析:(1)NF3构型为三角锥体,沸点-129 ℃,因而是分子晶体。制备 NF3的化学反应方程式为 4NH3+3F2 ===NF3+3NH4F。
(2)①价电子和原子数分别都相等的是等电子体,剩余与N3-互为等电子体的分子、离子有N2O(CO2或CS2);SCN—(CNO—)。CO2是直线型结构,所以N3-的空间构型也是直线型结构。
②根据构造原理可知,钴原子在基态时的价电子排布式为3d74s2 。[Co (N3)(NH3)5]SO4中含有6该配体,所以钴的配位数为6。由于N3-的空间构型是直线型结构,所以是sp杂化。
(3)根据相似相溶原理可知,该异构体是极性分子。
(4)钠离子半径小于钾离子的,所以NaN3的晶格能大于KN3的,A不正确。非金属性越强,第一电离能越大,但由于P原子的3p轨道电子是半充满状态,稳定性强,所以大于硫原子的第一电离能,B正确。钠是体心立方堆积,所以含有的钠原子是8×1/8+1=2,C正确。由于氮气分子中键能很大,所以氮气非常稳定,D不正确,答案选BC。
本题难度:一般
3、选择题 38.4 mg铜与一定量的浓硝酸反应,铜全部反应后,共收集到气体22.4 mL(标准状况),反应消耗硝酸的物质的量是(?)
A.1×10-3 mol
B.1.6×10-3 mol
C.2.2×10-3 mol
D.2.4×10-3 mol
参考答案:C
本题解析:解法1(极值法):若全部为NO2,根据化学反应方程式得其体积应为:
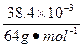 ×2×22.4 L·mol-1=26.88×10-3 L="26.88" mL。
×2×22.4 L·mol-1=26.88×10-3 L="26.88" mL。
故产生的气体为NO2和NO混合气。
若按Cu+4HNO3====Cu(NO3)2+2NO2↑+2H2O考虑,消耗HNO3量最大,
n(HNO3)=0.6×10-3 mol×4=2.4×10-3 mol
若按3Cu+8HNO3====3Cu(NO3)2+2NO↑+4H2O考虑,消耗HNO3量最少:
n(HNO3)=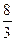 ×0.6×10-3 mol=1.6×10-3 mol
×0.6×10-3 mol=1.6×10-3 mol
实际消耗硝酸介于1.6×10-3 mol与2.4×10-3 mol之间。正确答案为C。
解法2(列方程求解):假设生成NO2物质的量为x,NO物质的量为y。
Cu+4HNO3====Cu(NO3)2+2NO2↑+2H2O
1? 4? 2
 ?2x? x
?2x? x
3Cu+8HNO3====3Cu(NO3)2+2NO↑+4H2O
3? 8? 2
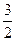 y 4y? y
y 4y? y
依题有:
x=9×10-4 mol? y=10-4 mol
所以消耗的HNO3物质的量:2x+4y=2×9×10-4 mol+4×10-4 mol=2.2×10-3 mol
选择C。
解法3(N守恒法):
反应中被还原的HNO3的物质的量为n(NOx)=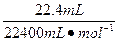 =10-3 mol
=10-3 mol
反应中起酸性作用的硝酸的物质的量为2n〔Cu(NO3)2〕=2×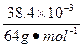 =1.2×10-3 mol
=1.2×10-3 mol
反应中共消耗硝酸的总物质的量=1.0×10-3 mol+1.2×10-3 mol=2.2×10-3 mol
选择C。
本题难度:简单
4、选择题 相同质量的四份铜片,分别置于足量下列酸中,所得气体的物质的量最多的是(? )
A.稀硫酸
B.浓硫酸
C.稀硝酸
D.浓硝酸
参考答案:D
本题解析:
正确答案:D
A、不反应;B、Cu~SO2 C、3Cu~2NO ;D、Cu ~2NO2,根据B、C、D的关系式,D产生的气体最多。
本题难度:简单
5、选择题 将7. 68 g铜粉与一定质量浓硝酸反应,当铜完全作用时,收集到气体4.48 L(标况下),则所消耗硝酸的物质的量是(?)
A.0.44 mol
B.0.33 mol
C.0.22 mol
D.0.11 mol
参考答案:A
本题解析:略
本题难度:简单